题目内容
16.对已达化学平衡的反应3H2(g)+N2 (g)?2NH3(g)△H<0,降低温度对化学平衡的影响是( )| A. | 正、逆反应速率都减小,平衡向正反应方向移动 | |
| B. | 正、逆反应速率都增大,平衡向正反应方向移动 | |
| C. | 逆反应速率増大,正反应速率减小,平衡向逆反应方向移动 | |
| D. | 逆反应速率减小,正反应速率増大,平衡向正反应方向移动 |
分析 对于反应3H2(g)+N2 (g)?2NH3(g)△H<0,正反应为放热反应,降低温度,正逆反应速率都降低,平衡向放热方向移动,以此解答该题.
解答 解:降低温度,正逆反应速率都减小,正反应为放热反应,降低温度,平衡正向移动,
故选A.
点评 本题考查化学平衡的影响因素,为高频考点,侧重于的分析能力的考查,注意把握反应速率以及平衡移动的特点,难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
7.常温常压下为气体的有机物是( )
①一氯甲烷 ②二氯甲烷 ③甲醇 ④甲醛 ⑤乙酸.
①一氯甲烷 ②二氯甲烷 ③甲醇 ④甲醛 ⑤乙酸.
| A. | ①② | B. | ②④⑤ | C. | ③⑤ | D. | ①④ |
4.科学家发现,不管化学反应是一步完成还是分几步完成,该反应的热效应是相同的.已知在25℃,105 Pa时,1mol石墨和1mol一氧化碳完全燃烧生成二氧化碳时的放热分别是△H=-393.5kJ/mol和△H=-283kJ/mol,下列说法或方程式正确的是( )
| A. | 在相同条件下:2C(石墨,s)+O2(g)═2CO(g)△H=-110.5 kJ/mol | |
| B. | 1 mol石墨不完全燃烧,生成CO2和CO混合气体时,放热504.0 kJ | |
| C. | 在相同条件下,C(石墨,s)+CO2(g)═2CO(g)△H=+172.5 kJ/mol | |
| D. | 已知金刚石不如石墨稳定,则石墨转变为金刚石需要放热 |
11.200mL5mol/L的Na2CO3溶液中,含有的Na+数是( )
| A. | 1 | B. | 2 | C. | 6.02×1023 | D. | 1.204×1024 |
2.大多数城市的空气质量实时发布系统将以实时空气质量指数替代原料的AQI指数,燃煤烟气和汽车尾气是引发
AQI指数上升的主要污染源,因此,对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的,汽车尾气脱硝脱碳的主要原理为:2NO(g)+2CO(g)?N2(g)+2CO(g)△H<0,一定条件下用气体传感器测得该反应在不同时间的NO和CO的浓度如下表
(1)下列措施既能提高NO的转化率,又能提高反应速率的是A(填字母)
A.增大压强 B.上高温度C.加催化剂 D.降低温度
(2)前2 s内的平均反应速率v(CO2)=3.75×10-4mol/(L•s),CO平衡转化率为25%
(3)该反应的平衡常数K为5000
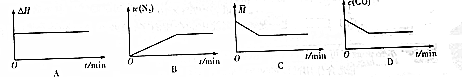
(4)在恒温密闭容器中充入CO、NO气体,下列图象如图能正确表面可逆反应达到平衡状态的是BD
(5)①已知
根据表中提供的数据可知,在溶液中不能大量共存的微粒是CD
A.HCO3-、HSO3-
B.HCO3-、SO32-
C HCO3-、H2SO3
D.HSO3-、CO32-
②等物质量浓度的5种溶液:
a.NH4Cl
b.(NH4)2SO4
c.(NH4)2CO3
d.NH4Al(SO4)2
e.CH3COONH4.
c(NH4+)由大到小的顺序是b>c>d>a>e(填字母)
(6)设计如图装置模拟传感器测定CO与NO的反应原理.
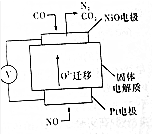
①铂丝电极为正极(填“正极”或“负极”)
②负极反应式为CO+O2--2e-=CO2.
AQI指数上升的主要污染源,因此,对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的,汽车尾气脱硝脱碳的主要原理为:2NO(g)+2CO(g)?N2(g)+2CO(g)△H<0,一定条件下用气体传感器测得该反应在不同时间的NO和CO的浓度如下表
| 时间/s | c(NO)/mol•L-1 | c(CO)/mol•L-1 |
| 0 | 1.00×10-3 | 3.60×10-3 |
| 1 | 4.50×10-4 | 3.05×10-3 |
| 2 | 2.50×10-4 | 2.85×10-3 |
| 3 | 1.50×10-4 | 2.75×10-3 |
| 4 | 1.00×10-4 | 2.70×10-3 |
| 5 | 1.00×10-4 | 2.70×10-3 |
A.增大压强 B.上高温度C.加催化剂 D.降低温度
(2)前2 s内的平均反应速率v(CO2)=3.75×10-4mol/(L•s),CO平衡转化率为25%
(3)该反应的平衡常数K为5000
(4)在恒温密闭容器中充入CO、NO气体,下列图象如图能正确表面可逆反应达到平衡状态的是BD

(5)①已知
| 化学式 | 电离常数 |
| H2SO3 | K1=1.3×10-2,K2=6.2×10-8 |
| H2CO3 | K1=4.3×10-7,K2=5.6×1011 |
A.HCO3-、HSO3-
B.HCO3-、SO32-
C HCO3-、H2SO3
D.HSO3-、CO32-
②等物质量浓度的5种溶液:
a.NH4Cl
b.(NH4)2SO4
c.(NH4)2CO3
d.NH4Al(SO4)2
e.CH3COONH4.
c(NH4+)由大到小的顺序是b>c>d>a>e(填字母)
(6)设计如图装置模拟传感器测定CO与NO的反应原理.

①铂丝电极为正极(填“正极”或“负极”)
②负极反应式为CO+O2--2e-=CO2.
 2010年亚运会在我国广州成功举办,整个亚运会体现了环保理念.
2010年亚运会在我国广州成功举办,整个亚运会体现了环保理念. 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为实验装置.