题目内容
19.下列电离方程式中正确的是( )| A. | Al2(SO4)3═2Al3++3SO42- | B. | FeCl2═Fe2++3Cl- | ||
| C. | H2SO4═H2++SO42- | D. | Ca(OH)2═Ca2++2(OH-) |
分析 A.Al2(SO4)3完全电离出铝离子和硫酸根离子;
B.电荷不守恒;
C.氢离子的符号错误;
D.氢氧根离子不用加括号.
解答 解:A.Al2(SO4)3完全电离出铝离子和硫酸根离子,则电离方程式为:Al2(SO4)3═2Al3++3SO42-,故A正确;
B.FeCl2的电离方程式为FeCl2═Fe2++2Cl-,故B错误;
C.硫酸电离出2个氢离子,则电离方程式为H2SO4═2H++SO42-,故C错误;
D.氢氧化钙电离出钙离子和两个氢氧根离子,则电离方程式为Ca(OH)2═Ca2++2OH-,故D错误.
故选A.
点评 本题考查电离方程式的书写知识,注意强电解质在溶液中能完全电离,弱电解质部分电离,离子团在电离方程式中不能拆开,强酸的酸式根离子要拆开,弱酸的酸式根离子不能拆开,题目难度不大.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
10.乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇:
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)①298K时,K1=2.95×1011
2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g)②298K时,K2=1.71×1022
(1)条件相同时,反应①与反应②相比,转化程度更大的是②.
(2)在一定压强下,测得反应①的实验数据如表:
根据表中数据分析:…
①温度升高,K值减小(填“增大”“减小”或“不变”).
②提高氢碳比[n(H2)/n(CO2)],对生成乙醇有利(填“有利”或“不利”).
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)①298K时,K1=2.95×1011
2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g)②298K时,K2=1.71×1022
(1)条件相同时,反应①与反应②相比,转化程度更大的是②.
(2)在一定压强下,测得反应①的实验数据如表:
| 温度(K) CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
①温度升高,K值减小(填“增大”“减小”或“不变”).
②提高氢碳比[n(H2)/n(CO2)],对生成乙醇有利(填“有利”或“不利”).
7.常温常压下为气体的有机物是( )
①一氯甲烷 ②二氯甲烷 ③甲醇 ④甲醛 ⑤乙酸.
①一氯甲烷 ②二氯甲烷 ③甲醇 ④甲醛 ⑤乙酸.
| A. | ①② | B. | ②④⑤ | C. | ③⑤ | D. | ①④ |
4.科学家发现,不管化学反应是一步完成还是分几步完成,该反应的热效应是相同的.已知在25℃,105 Pa时,1mol石墨和1mol一氧化碳完全燃烧生成二氧化碳时的放热分别是△H=-393.5kJ/mol和△H=-283kJ/mol,下列说法或方程式正确的是( )
| A. | 在相同条件下:2C(石墨,s)+O2(g)═2CO(g)△H=-110.5 kJ/mol | |
| B. | 1 mol石墨不完全燃烧,生成CO2和CO混合气体时,放热504.0 kJ | |
| C. | 在相同条件下,C(石墨,s)+CO2(g)═2CO(g)△H=+172.5 kJ/mol | |
| D. | 已知金刚石不如石墨稳定,则石墨转变为金刚石需要放热 |
11.200mL5mol/L的Na2CO3溶液中,含有的Na+数是( )
| A. | 1 | B. | 2 | C. | 6.02×1023 | D. | 1.204×1024 |
2.大多数城市的空气质量实时发布系统将以实时空气质量指数替代原料的AQI指数,燃煤烟气和汽车尾气是引发
AQI指数上升的主要污染源,因此,对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的,汽车尾气脱硝脱碳的主要原理为:2NO(g)+2CO(g)?N2(g)+2CO(g)△H<0,一定条件下用气体传感器测得该反应在不同时间的NO和CO的浓度如下表
(1)下列措施既能提高NO的转化率,又能提高反应速率的是A(填字母)
A.增大压强 B.上高温度C.加催化剂 D.降低温度
(2)前2 s内的平均反应速率v(CO2)=3.75×10-4mol/(L•s),CO平衡转化率为25%
(3)该反应的平衡常数K为5000
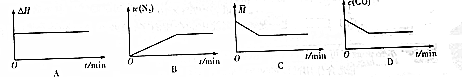
(4)在恒温密闭容器中充入CO、NO气体,下列图象如图能正确表面可逆反应达到平衡状态的是BD
(5)①已知
根据表中提供的数据可知,在溶液中不能大量共存的微粒是CD
A.HCO3-、HSO3-
B.HCO3-、SO32-
C HCO3-、H2SO3
D.HSO3-、CO32-
②等物质量浓度的5种溶液:
a.NH4Cl
b.(NH4)2SO4
c.(NH4)2CO3
d.NH4Al(SO4)2
e.CH3COONH4.
c(NH4+)由大到小的顺序是b>c>d>a>e(填字母)
(6)设计如图装置模拟传感器测定CO与NO的反应原理.
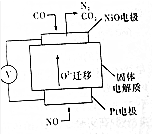
①铂丝电极为正极(填“正极”或“负极”)
②负极反应式为CO+O2--2e-=CO2.
AQI指数上升的主要污染源,因此,对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的,汽车尾气脱硝脱碳的主要原理为:2NO(g)+2CO(g)?N2(g)+2CO(g)△H<0,一定条件下用气体传感器测得该反应在不同时间的NO和CO的浓度如下表
| 时间/s | c(NO)/mol•L-1 | c(CO)/mol•L-1 |
| 0 | 1.00×10-3 | 3.60×10-3 |
| 1 | 4.50×10-4 | 3.05×10-3 |
| 2 | 2.50×10-4 | 2.85×10-3 |
| 3 | 1.50×10-4 | 2.75×10-3 |
| 4 | 1.00×10-4 | 2.70×10-3 |
| 5 | 1.00×10-4 | 2.70×10-3 |
A.增大压强 B.上高温度C.加催化剂 D.降低温度
(2)前2 s内的平均反应速率v(CO2)=3.75×10-4mol/(L•s),CO平衡转化率为25%
(3)该反应的平衡常数K为5000
(4)在恒温密闭容器中充入CO、NO气体,下列图象如图能正确表面可逆反应达到平衡状态的是BD

(5)①已知
| 化学式 | 电离常数 |
| H2SO3 | K1=1.3×10-2,K2=6.2×10-8 |
| H2CO3 | K1=4.3×10-7,K2=5.6×1011 |
A.HCO3-、HSO3-
B.HCO3-、SO32-
C HCO3-、H2SO3
D.HSO3-、CO32-
②等物质量浓度的5种溶液:
a.NH4Cl
b.(NH4)2SO4
c.(NH4)2CO3
d.NH4Al(SO4)2
e.CH3COONH4.
c(NH4+)由大到小的顺序是b>c>d>a>e(填字母)
(6)设计如图装置模拟传感器测定CO与NO的反应原理.

①铂丝电极为正极(填“正极”或“负极”)
②负极反应式为CO+O2--2e-=CO2.
3.橙花醛是一种香料,其结构简式为(CH3)2C═CHCH2CH2C(CH3)═CHCHO.下列说法正确的是( )
| A. | 橙花醛不能与Br2发生加成反应 | |
| B. | 橙花醛能发生银镜反应 | |
| C. | 1 mol橙花醛最多可以与2 mol H2发生加成反应 | |
| D. | 橙花醛是乙烯的同系物 |
