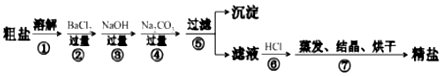
题目内容
18. 氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代.请回答:
氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代.请回答:(1)氯碱工业生产氯气的化学方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑.
(2)84消毒液与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
(3)二氧化氯是目前国际上公认的最新一代的高效、广谱、安全的杀菌、保鲜剂.我国科学家研发了用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯的方法,其化学方程式为Cl2+2NaClO2=2ClO2+2NaCl.
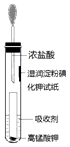
(4)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧化性强弱的微型装置(如图).
①下列溶液能吸收Cl2的是BC(填字母序号).
A.饱和食盐水 B.饱和Na2SO3溶液C.饱和NaOH溶液 D.浓硫酸
②能说明Cl2的氧化性强于I2的实验现象是湿润淀粉碘化钾试纸变蓝,从原子结构角度解释Cl2的氧化性强于I2的原因:同主族元素从上到下,原子半径依次变大,得电子能力依次减弱,氧化能力依次减弱.
分析 (1)氯碱工业生产氯气,电解饱和食盐水;
(2)用氯气与烧碱溶液反应制备84消毒液,生成NaCl、NaClO、水;
(3)用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯,还生成NaCl;
(4)①碱性溶液及具有还原性的物质可吸收氯气;
②说明Cl2的氧化性强于I2的实验,利用氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性说明.
解答 解:(1)氯碱工业生产氯气,电解饱和食盐水,反应为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑,故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑;
(2)用氯气与烧碱溶液反应制备84消毒液,生成NaCl、NaClO、水,离子反应为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯,还生成NaCl,反应为Cl2+2NaClO2=2ClO2+2NaCl,故答案为:Cl2+2NaClO2=2ClO2+2NaCl;
(4)①C为碱性溶液,B具有还原性,则BC中的物质可吸收氯气,故答案为:BC;
②说明Cl2的氧化性强于I2的实验,氯气氧化KI生成碘,使淀粉KI试纸变蓝,即湿润淀粉碘化钾试纸变蓝能说明Cl2的氧化性强于I2,由于同主族元素从上到下,原子半径依次变大,得电子能力依次减弱,氧化能力依次减弱,故答案为:湿润淀粉碘化钾试纸变蓝;同主族元素从上到下,原子半径依次变大,得电子能力依次减弱,氧化能力依次减弱.
点评 本题考查氯气的化学性质,为高频考点,把握习题中的信息、物质的氧化性及发生的反应为解答的关键,侧重分析能力与化学用语应用的考查,题目难度不大.

 催化还原CO2是解决温室效应及能源问题的重要手段之一.研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO.反应的热化学方程式如下:
催化还原CO2是解决温室效应及能源问题的重要手段之一.研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO.反应的热化学方程式如下:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1 I
CO2(g)+H2(g)?CO(g)+H2O(g)△H2 II
某实验室控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据:
| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
已知:①CO和H2的标准燃烧热分别为-283.0kJ•mol-1和-285.8kJ•mol-1
②H2O(l)═H2O(g)△H3=44.0kJ•mol-1
请回答(不考虑温度对△H的影响):
(1)反应I的平衡常数表达式K=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}({H}_{2})}$;反应II的△H2=+41.2kJ•mol-1.
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有CD.
A.使用催化剂Cat.1B.使用催化剂Cat.2C.降低反应温度
D.投料比不变,增加反应物的浓度 E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是表中数据表明此时未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而在该时刻下对甲醇选择性有影响.
(4)在图中分别画出I在无催化剂、有Cat.1和由Cat.2三种情况下“反应过程-能量”示意图.
(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在阴极,该电极反应式是CO2+6H++6e-=CH3OH+H2O.
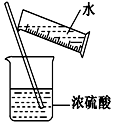 进行化学实验必须注意安全,下列说法中正确的组合是( )
进行化学实验必须注意安全,下列说法中正确的组合是( )①点燃氢气前要检验氢气的纯度,以免发生爆炸
②CO有毒,处理CO气体时可将其点燃,转化为无毒的CO2
③在盛O2的集气瓶中进行铁丝燃烧实验时,事先在集气瓶底部铺上一层沙子
④用氢气还原氧化铜时,先加热再通入氢气,以免浪费氢气
⑤稀释浓硫酸的操作如图所示.
| A. | ①②③④ | B. | ①②③ | C. | ①②④ | D. | ①②③④⑤ |
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)①298K时,K1=2.95×1011
2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g)②298K时,K2=1.71×1022
(1)条件相同时,反应①与反应②相比,转化程度更大的是②.
(2)在一定压强下,测得反应①的实验数据如表:
| 温度(K) CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
①温度升高,K值减小(填“增大”“减小”或“不变”).
②提高氢碳比[n(H2)/n(CO2)],对生成乙醇有利(填“有利”或“不利”).
①一氯甲烷 ②二氯甲烷 ③甲醇 ④甲醛 ⑤乙酸.
| A. | ①② | B. | ②④⑤ | C. | ③⑤ | D. | ①④ |
AQI指数上升的主要污染源,因此,对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的,汽车尾气脱硝脱碳的主要原理为:2NO(g)+2CO(g)?N2(g)+2CO(g)△H<0,一定条件下用气体传感器测得该反应在不同时间的NO和CO的浓度如下表
| 时间/s | c(NO)/mol•L-1 | c(CO)/mol•L-1 |
| 0 | 1.00×10-3 | 3.60×10-3 |
| 1 | 4.50×10-4 | 3.05×10-3 |
| 2 | 2.50×10-4 | 2.85×10-3 |
| 3 | 1.50×10-4 | 2.75×10-3 |
| 4 | 1.00×10-4 | 2.70×10-3 |
| 5 | 1.00×10-4 | 2.70×10-3 |
A.增大压强 B.上高温度C.加催化剂 D.降低温度
(2)前2 s内的平均反应速率v(CO2)=3.75×10-4mol/(L•s),CO平衡转化率为25%
(3)该反应的平衡常数K为5000
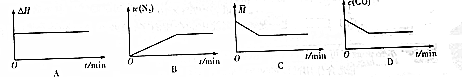
(4)在恒温密闭容器中充入CO、NO气体,下列图象如图能正确表面可逆反应达到平衡状态的是BD
(5)①已知
| 化学式 | 电离常数 |
| H2SO3 | K1=1.3×10-2,K2=6.2×10-8 |
| H2CO3 | K1=4.3×10-7,K2=5.6×1011 |
A.HCO3-、HSO3-
B.HCO3-、SO32-
C HCO3-、H2SO3
D.HSO3-、CO32-
②等物质量浓度的5种溶液:
a.NH4Cl
b.(NH4)2SO4
c.(NH4)2CO3
d.NH4Al(SO4)2
e.CH3COONH4.
c(NH4+)由大到小的顺序是b>c>d>a>e(填字母)
(6)设计如图装置模拟传感器测定CO与NO的反应原理.
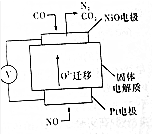
①铂丝电极为正极(填“正极”或“负极”)
②负极反应式为CO+O2--2e-=CO2.