题目内容
 汽车尾气是城市的主要空气污染物,研究控制汽车尾气是保护环境的首要任务.
汽车尾气是城市的主要空气污染物,研究控制汽车尾气是保护环境的首要任务.(1)汽车内燃机工作时发生反应:N2(g)+O2(g)?2NO(g),是导致汽车尾气中含有NO的原因之一. t℃时,向 2L密闭容器中充入3mol N2和4mol O2,在10min时反应达到平衡状态,此时容器中NO的物质的量浓度是2mol.L-1.
①10min内该反应的平均速率υ(NO)=
②反应开始至达到平衡的过程中,容器中下列各项发生变化的是
a.混合气体的密度
b.混合气体NO的质量分数
c.混合气体平均摩尔质量
d.N2的转化率
(2)H2或CO可以催化还原NO以达到消除污染的目的.
已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ?mol-1
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是
(3)当质量一定时,增大固体催化剂的表面积可提高化学反应速率.如图表示在其他条件不变时,反应:2NO(g)+2CO(g)?2CO2(g)+N2(g)中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线.
①该反应的△H
②该反应在
③若催化剂的表面积S1>S2,在右图中画出c(NO)在T1、S2 条件下达到平衡过程中的变化曲线.
考点:化学平衡的计算,用盖斯定律进行有关反应热的计算,体积百分含量随温度、压强变化曲线
专题:化学反应中的能量变化,化学平衡专题
分析:(1)①利用三段法“开始 变化 平衡”列出各组分数据,代入化学反应速率和化学平衡常数表达式计算;
②a.混合气体的总质量不变,容器的体积不变,据此判断;
b.随反应进行,反应物浓度升高,则混合气体NO的质量分数增大;
c.混合气体的总质量不变,反应前后的物质的量也不变,据此判断;
d.随反应进行,反应物N2的转化率不断升高;
(2)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的计算;
(3)①根据到达平衡的时间,判断温度高低,再根据不同温度下到达平衡时NO的浓度高低,判断温度对平衡的影响,据此判断反应热效应;
②根据2NO(g)+2CO(g)?2CO2(g)+N2(g),则△S<0结合△G=△H-T△S<0自发来判断;
③催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时NO的浓度相同,据此作图.
②a.混合气体的总质量不变,容器的体积不变,据此判断;
b.随反应进行,反应物浓度升高,则混合气体NO的质量分数增大;
c.混合气体的总质量不变,反应前后的物质的量也不变,据此判断;
d.随反应进行,反应物N2的转化率不断升高;
(2)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的计算;
(3)①根据到达平衡的时间,判断温度高低,再根据不同温度下到达平衡时NO的浓度高低,判断温度对平衡的影响,据此判断反应热效应;
②根据2NO(g)+2CO(g)?2CO2(g)+N2(g),则△S<0结合△G=△H-T△S<0自发来判断;
③催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时NO的浓度相同,据此作图.
解答:
解:(1)①由题中所给数据可知:
N2(g)+O2(g)?2NO(g)
起始浓度(mol?L-1)1.5 2 0
转化浓度(mol?L-1)1 1 2
平衡浓度(mol?L-1)0.5 1 2
则υ(NO)=
=0.2mol/(L?min),K=
=
=8,
故答案为:0.2mol/(L?min);8;
②a.混合气体的总质量不变,容器的体积不变,混合气体的密度不变,故a不符合;
b.随反应进行,反应物浓度升高,则混合气体NO的质量分数增大,故b符合;
c.混合气体的总质量不变,反应前后的物质的量也不变,混合气体平均摩尔质量不变,故c不符合;
d.随反应进行,随反应进行,反应物N2的转化率不断升高,故d符合;
故答案为:bd;
(2)①已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
②2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ?mol-1
依据盖斯定律可知②-①得:2H2(g)+2NO(g)=N2(g)+2H2O(l)△H,
△H=(-571.6kJ/mol)-180.5kJ/mol═-752.1kJ/mol,
故答案为:2H2(g)+2NO(g)=N2(g)+2H2O(l)△H=-752.1kJ/mol;
(3)①、温度T2到达平衡的时间短,反应速率快,故温度T2>T1,温度越高,平衡时NO的浓度越高,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0,故答案为:<;
②根据2NO(g)+2CO(g)?2CO2(g)+N2(g),则△S<0,又据①△H<0,结合△G=△H-T△S<0自发,所以在高温下才能自发,故答案为:高温下;
③、催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时NO的浓度相同,故c(NO) 在T1、S2条件下达到平衡过程中的变化曲线为: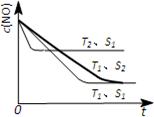 ,故答案为:
,故答案为: .
.
N2(g)+O2(g)?2NO(g)
起始浓度(mol?L-1)1.5 2 0
转化浓度(mol?L-1)1 1 2
平衡浓度(mol?L-1)0.5 1 2
则υ(NO)=
| 2.0mol/L |
| 10min |
| c 2(NO) |
| c(N 2)c(O 2) |
| 2 2 |
| 0.5×1 |
故答案为:0.2mol/(L?min);8;
②a.混合气体的总质量不变,容器的体积不变,混合气体的密度不变,故a不符合;
b.随反应进行,反应物浓度升高,则混合气体NO的质量分数增大,故b符合;
c.混合气体的总质量不变,反应前后的物质的量也不变,混合气体平均摩尔质量不变,故c不符合;
d.随反应进行,随反应进行,反应物N2的转化率不断升高,故d符合;
故答案为:bd;
(2)①已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
②2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ?mol-1
依据盖斯定律可知②-①得:2H2(g)+2NO(g)=N2(g)+2H2O(l)△H,
△H=(-571.6kJ/mol)-180.5kJ/mol═-752.1kJ/mol,
故答案为:2H2(g)+2NO(g)=N2(g)+2H2O(l)△H=-752.1kJ/mol;
(3)①、温度T2到达平衡的时间短,反应速率快,故温度T2>T1,温度越高,平衡时NO的浓度越高,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0,故答案为:<;
②根据2NO(g)+2CO(g)?2CO2(g)+N2(g),则△S<0,又据①△H<0,结合△G=△H-T△S<0自发,所以在高温下才能自发,故答案为:高温下;
③、催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时NO的浓度相同,故c(NO) 在T1、S2条件下达到平衡过程中的变化曲线为:
 ,故答案为:
,故答案为: .
.
点评:本题涉及反应速率和化学平衡的综合应用,应用盖斯定律求焓变,培养学生的平衡思想,综合性强,难度中等,三段式是解平衡题常用的方法,(3)中注意根据“先拐先平数值大”原则判断温度高低是关键,作图时注意到达平衡的时间与平衡时NO的浓度.

练习册系列答案
相关题目
下列物质的电离方程式,正确的是( )
| A、加热NH4HCO3至熔融状态:NH4HCO3═NH4++HCO3? |
| B、CO2通入水中得到H2CO3:H2CO3═2H++CO32? |
| C、醋酸钠溶于水:CH3COONa═CH3COO-+Na+ |
| D、C2H5OH溶于水:C2H5OH═C2H5++OH- |