题目内容
下列物质的电离方程式,正确的是( )
| A、加热NH4HCO3至熔融状态:NH4HCO3═NH4++HCO3? |
| B、CO2通入水中得到H2CO3:H2CO3═2H++CO32? |
| C、醋酸钠溶于水:CH3COONa═CH3COO-+Na+ |
| D、C2H5OH溶于水:C2H5OH═C2H5++OH- |
考点:电离方程式的书写
专题:
分析:A.碳酸氢铵不稳定受热分解;
B.多元弱酸分步电离;
C.醋酸钠为强电解质,完全电离;
D.乙醇为非电解质.
B.多元弱酸分步电离;
C.醋酸钠为强电解质,完全电离;
D.乙醇为非电解质.
解答:
解:A.碳酸氢铵不稳定受热分解,故A错误;
B.碳酸为多元弱酸分步电离,电离方程式为:H2CO3 H++HCO3?,HCO3?
H++HCO3?,HCO3? H++CO32?,故B错误;
H++CO32?,故B错误;
C.醋酸钠溶于水,完全电离,电离方程式:CH3COONa═CH3COO-+Na+,故C正确;
D.乙醇为非电解质,不能电离,故D错误;
故选:C.
B.碳酸为多元弱酸分步电离,电离方程式为:H2CO3
 H++HCO3?,HCO3?
H++HCO3?,HCO3? H++CO32?,故B错误;
H++CO32?,故B错误;C.醋酸钠溶于水,完全电离,电离方程式:CH3COONa═CH3COO-+Na+,故C正确;
D.乙醇为非电解质,不能电离,故D错误;
故选:C.
点评:本题考查了电离方程式的书写,明确电解质的强弱及电离方程式的书写规则是解本题关键,题目难度不大.

练习册系列答案
相关题目
一种从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的工艺流程如下下列说法中正确的是( )
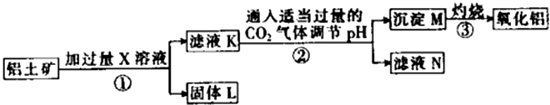

| A、X既可以是HCl,也可以是NaOH |
| B、第②步反应的离子方程式为2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
| C、固体L中含有Fe2O3和MgO等 |
| D、滤液N经蒸干、灼烧后可以得到纯净的Na2CO3固体 |
 汽车尾气是城市的主要空气污染物,研究控制汽车尾气是保护环境的首要任务.
汽车尾气是城市的主要空气污染物,研究控制汽车尾气是保护环境的首要任务.
 A-H分别是中学化学中的常见物质,它们之间有下图所示关系(反应中所需要和所生成的水均没有列出),已知B、H为常见的金属单质,A、C均为气体单质且A气体的颜色为黄绿色,F的水溶液为蓝色,B、D、G、E中均含同一种元素.请回答:
A-H分别是中学化学中的常见物质,它们之间有下图所示关系(反应中所需要和所生成的水均没有列出),已知B、H为常见的金属单质,A、C均为气体单质且A气体的颜色为黄绿色,F的水溶液为蓝色,B、D、G、E中均含同一种元素.请回答: