题目内容
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,并回答下列问题:
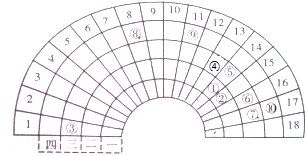
(1)若①~⑩分别代表十种常见元素,则⑩代表的元素是常见元素周期表中处于第 周期,第 族,⑨的基态原子价电子排布式为 .
(2)⑤、⑥、⑦、⑩四种元素的气态氢化物稳定性最大的是 (填化学式),单质熔点最高的是 (填单质名称).⑨的单质具有良好的导电性,是因为其晶体中存在 .

(1)若①~⑩分别代表十种常见元素,则⑩代表的元素是常见元素周期表中处于第
(2)⑤、⑥、⑦、⑩四种元素的气态氢化物稳定性最大的是
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据图片知,阿拉伯数字表示周期表的列,大写数字表示周期数,根据元素在周期表中的位置知,①~⑩分别是C、N、Na、Al、Si、S、Cl、Fe、Cu、Br元素,
(1)根据溴原子的位置以及基态原子价电子排布知识来回答;
(2)元素的非金属性越强,则气态氢化物稳定性越强,原子晶体的熔点较高,金属导电的原因是金属内部存在自由移动的电子的缘故.
(1)根据溴原子的位置以及基态原子价电子排布知识来回答;
(2)元素的非金属性越强,则气态氢化物稳定性越强,原子晶体的熔点较高,金属导电的原因是金属内部存在自由移动的电子的缘故.
解答:
解:根据图片知,阿拉伯数字表示周期表的列,大写数字表示周期数,根据元素在周期表中的位置知,①~⑩分别是C、N、Na、Al、Si、S、Cl、Fe、Cu、Br元素,
(1)溴原子的位置:第四周期,ⅤⅡA族,Br是35号元素,原子核外电子数为35,原子的基态原子价电子电子排布式为:4s24p5,故答案为:故答案为:四;ⅤⅡA;4s24p5;
(2)Si、S、Cl、Br中,Cl元素的非金属性越强,则气态氢化物HCl稳定性最强,原子晶体Si的熔点高,金属导电的原因是金属内部存在自由移动的电子的缘故,故答案为:HCl;Si;自由移动的电子.
(1)溴原子的位置:第四周期,ⅤⅡA族,Br是35号元素,原子核外电子数为35,原子的基态原子价电子电子排布式为:4s24p5,故答案为:故答案为:四;ⅤⅡA;4s24p5;
(2)Si、S、Cl、Br中,Cl元素的非金属性越强,则气态氢化物HCl稳定性最强,原子晶体Si的熔点高,金属导电的原因是金属内部存在自由移动的电子的缘故,故答案为:HCl;Si;自由移动的电子.
点评:本题考查了元素周期表和元素周期律应用,正确连接扇形图所表达的含义是解本题关键,再结合元素化合物知识来分析解答,同时考查学生对基础知识的掌握、知识框架的构成、综合知识的应用能力,难度中等.

练习册系列答案
相关题目
分子式为C9H12的所有带苯环结构的异构体中,在催化剂条件下与液溴发生取代反应,其一溴代物为三种的结构有( )
| A、1种 | B、2种 | C、3种 | D、4种 |
一种从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的工艺流程如下下列说法中正确的是( )
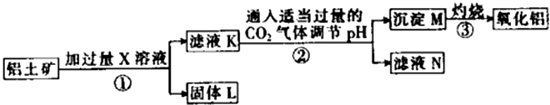

| A、X既可以是HCl,也可以是NaOH |
| B、第②步反应的离子方程式为2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
| C、固体L中含有Fe2O3和MgO等 |
| D、滤液N经蒸干、灼烧后可以得到纯净的Na2CO3固体 |
在100mL AlCl3溶液中逐滴加入KOH溶液,当KOH溶液的体积为30mL和70mL时,所得沉淀质量相等,则原AlCl3溶液和KOH溶液的物质的量浓度之比为( )
| A、5:1 | B、1:5 |
| C、3:7 | D、7:3 |




 汽车尾气是城市的主要空气污染物,研究控制汽车尾气是保护环境的首要任务.
汽车尾气是城市的主要空气污染物,研究控制汽车尾气是保护环境的首要任务.