题目内容
茶是我国人民喜爱的饮品.某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有钙、铁、铝三种金属元素.
查阅部分资料:草酸铵[(NH4)2C2O4]属于弱电解质;草酸钙(CaC2O4)难溶于水;Ca2+、A13+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;A1(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1.试根据上述过程及信息填空:
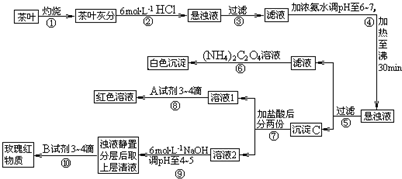
试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是
(2)写出检验Ca2+的离子方程式
(3)写出沉淀C所含主要物质的化学式
(4)写出步骤⑧用A试剂生成血红色溶液的离子方程式
(5)步骤⑨的作用是
(6)猜测步骤⑩的目的是 .
查阅部分资料:草酸铵[(NH4)2C2O4]属于弱电解质;草酸钙(CaC2O4)难溶于水;Ca2+、A13+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;A1(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1.试根据上述过程及信息填空:

试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是
(2)写出检验Ca2+的离子方程式
(3)写出沉淀C所含主要物质的化学式
(4)写出步骤⑧用A试剂生成血红色溶液的离子方程式
(5)步骤⑨的作用是
(6)猜测步骤⑩的目的是
考点:探究物质的组成或测量物质的含量,离子方程式的书写,物质分离和提纯的方法和基本操作综合应用
专题:实验题,物质检验鉴别题
分析:茶叶经灼烧,茶叶灰中含有钙、铁、铝三种金属元素,加入盐酸后可生成可溶性的氯化物,经过滤后,在滤液中加入氨水调节pH6~7,加热至沸30min,经过滤得到的沉淀C为氢氧化铝和氢氧化铁沉淀,滤液为氯化钙溶液,加入草酸铵后可得草酸钙沉淀,在滤液中加入盐酸后分为两份,加入试剂A,溶液变成红色,则A应为KSCN溶液,溶液2中加入6mol/L的NaOH溶液调pH至4,可得到氢氧化铁沉淀,浊液静置分层后上层清液为氯化铝溶液,加入试剂B可检验铝离子,生成红色络合物,以此进行解答.
解答:
解:茶叶经灼烧,茶叶灰中含有钙、铁、铝三种金属元素,加入盐酸后可生成可溶性的氯化物,经过滤后,在滤液中加入氨水调节pH6~7,加热至沸30min,经过滤得到的沉淀C为氢氧化铝和氢氧化铁沉淀,滤液为氯化钙溶液,加入草酸铵后可得草酸钙沉淀,在滤液中加入盐酸后分为两份,加入试剂A,溶液变成红色,则A应为KSCN溶液,溶液2中加入6mol/L的NaOH溶液调pH至4,可得到氢氧化铁沉淀,浊液静置分层后上层清液为氯化铝溶液,加入试剂B可检验铝离子,生成红色络合物;
(1)向茶叶灰分中加盐酸的作用是将其中的Ca2+、Al3+、Fe3+溶解,故答案为:使Ca2+、Al3+、Fe3+等离子溶解;
(2)⑤过滤后所得滤液中含Ca2+,检验Ca2+的离子方程式为:Ca2++(NH4)2C2O4=CaC2O4↓+2NH4+,故答案为:Ca2++(NH4)2C2O4=CaC2O4↓+2NH4+;
(3)步骤④在pH为6-7时加热30 min,可使Al3+、Fe3+转化成Al(OH)3和Fe(OH)3沉淀,故答案为:Fe(OH)3、Al(OH)3;
(4)步骤⑧是检验Fe3+,可加入KSCN 或NH4SCN进行检验,溶液变红色,反应的离子方程式为:Fe3++3SCN-=Fe(SCN)3,故答案为:Fe3++3SCN-=Fe(SCN)3;
(5)步骤⑨将pH值调节至4~5,此时铝离子没有沉淀而铁离子沉淀完全,故答案为:使Fe3+转化为Fe(OH)3沉淀;检验Al3+(或铝元素)存在;
(6)步骤⑩分离后用玫瑰红物质可检验Al元素的存在,故答案为:检验Al3+(或铝元素)存在.
(1)向茶叶灰分中加盐酸的作用是将其中的Ca2+、Al3+、Fe3+溶解,故答案为:使Ca2+、Al3+、Fe3+等离子溶解;
(2)⑤过滤后所得滤液中含Ca2+,检验Ca2+的离子方程式为:Ca2++(NH4)2C2O4=CaC2O4↓+2NH4+,故答案为:Ca2++(NH4)2C2O4=CaC2O4↓+2NH4+;
(3)步骤④在pH为6-7时加热30 min,可使Al3+、Fe3+转化成Al(OH)3和Fe(OH)3沉淀,故答案为:Fe(OH)3、Al(OH)3;
(4)步骤⑧是检验Fe3+,可加入KSCN 或NH4SCN进行检验,溶液变红色,反应的离子方程式为:Fe3++3SCN-=Fe(SCN)3,故答案为:Fe3++3SCN-=Fe(SCN)3;
(5)步骤⑨将pH值调节至4~5,此时铝离子没有沉淀而铁离子沉淀完全,故答案为:使Fe3+转化为Fe(OH)3沉淀;检验Al3+(或铝元素)存在;
(6)步骤⑩分离后用玫瑰红物质可检验Al元素的存在,故答案为:检验Al3+(或铝元素)存在.
点评:本题考查了物质性质和组成的实验探究实验分析判断,侧重于学生的分析和实验能力的考查,为高考常见题型,流程中的试剂特征和反应现象是解题关键,题目难度中等.

练习册系列答案
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目
分子式为C9H12的所有带苯环结构的异构体中,在催化剂条件下与液溴发生取代反应,其一溴代物为三种的结构有( )
| A、1种 | B、2种 | C、3种 | D、4种 |
短周期元素X、Y、Z、R、W五种元素原子序数依次增大,其中X与Z、Y与W分别为同族元素,原子半径X<Y<W<R<Z,W原子的最外层电子数比内层电子总数少4,Z、R的核外电子数之和与Y、W核外电子数之和相等.下列说法不正确的是( )
| A、工业上用电解法获得Z、R的单质 |
| B、Y、Z、R的简单离子具有相同的电子层结构 |
| C、由X与Y、X与W形成的化合物放在空气中都易变质 |
| D、由X、Y、Z形成的化合物能与X、Y、R形成的化合物发生复分解反应 |
把Ca(OH)2放入蒸馏水中,一定时间后达到如下平衡:Ca(OH)2(s)?Ca2+(aq)+2OH-(aq),加入以下固体,能使Ca(OH)2减少的是( )
| A、NaOH |
| B、Na2CO3 |
| C、CaCl2 |
| D、NaClO |
对于反应2A(g)+B(g)?2C(g)△H<0,下列图象正确的是( )


| A、①④ | B、②③ | C、①③ | D、②④ |
一种从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的工艺流程如下下列说法中正确的是( )
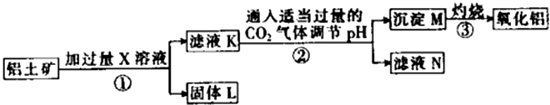

| A、X既可以是HCl,也可以是NaOH |
| B、第②步反应的离子方程式为2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
| C、固体L中含有Fe2O3和MgO等 |
| D、滤液N经蒸干、灼烧后可以得到纯净的Na2CO3固体 |
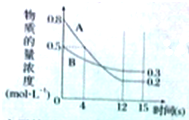 已知:反应aA(g)+bB(g)?cC(g)某温度下,在2L的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示.
已知:反应aA(g)+bB(g)?cC(g)某温度下,在2L的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示. 汽车尾气是城市的主要空气污染物,研究控制汽车尾气是保护环境的首要任务.
汽车尾气是城市的主要空气污染物,研究控制汽车尾气是保护环境的首要任务.