题目内容
10.将物质的量都为amol的金属钠和铝一同放入mg足量的水中,所得溶液的密度为ρg/cm3,则此溶液的物质的量浓度为( )| A. | $\frac{1000ρa}{48a+m}mol/L$ | B. | $\frac{1000ρa}{46a+m}$mol/L | ||
| C. | $\frac{1000ρa}{50a+m}mol/L$ | D. | $\frac{ρa}{46a+m}mol/L$ |
分析 将物质的量均为a mol的钠和铝投入足量水中发生反应:2Na+2H2O=2NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,由方程式可知,溶液为偏铝酸钠溶液,偏铝酸钠的物质的量为amol.根据方程式计算生成氢气的物质的量,在计算氢气质量,溶液质量为m(溶液)=m(金属)+m(H2O)-m(H2),据此计算溶液质量,利用V=$\frac{m}{ρ}$计算溶液体积,再利用c=$\frac{n}{V}$计算溶液物质的量浓度.
解答 解:钠和铝投入足量水中发生反应:2Na+2H2O=2NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,由方程式可知,a mol的钠反应生成amol氢氧化钠,生成氢气0.5amol;amol氢氧化钠与amol铝恰好反应生成amol偏铝酸钠,同时生成氢气1.5amol.溶液为偏铝酸钠溶液,所以氢气的质量为(0.5amol+1.5amol)×2g/mol=4ag,则溶液质量m(溶液)=m(金属)+m(H2O)-m(H2)=amol×23g/mol+amol×27g/mol+mg-4ag=(46a+m)g,
所得溶液的体积为:$\frac{(46a+m)g}{ρg/mL}$=$\frac{46a+m}{ρ}$mL,
所以溶液的物质的量浓度为:$\frac{amol}{\frac{46a+m}{ρ}×1{0}^{-3}L}$=$\frac{1000ρa}{46a+m}$mol/L,
故选B.
点评 本题考查物质的量浓度的计算,题目难度中等,判断所得溶液中溶质为偏铝酸钠是解题关键,然后利用物质的量浓度定义式计算,注意掌握物质的量浓度的概念及表达式,试题培养了学生的化学计算能力.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
7.下列说法正确的是( )
| A. | 氧化还原反应中氧化剂和还原剂一定是两种物质 | |
| B. | 氧化还原反应中氧化产物和还原产物一定是两种物质 | |
| C. | 作氧化剂的物质一定不能作还原剂 | |
| D. | 所含元素处于中间价态时的物质,既可作氧化剂也可作还原剂 |
1.下列仪器用于过滤和蒸发分离物质的是( )
①漏斗 ②试管 ③蒸发皿 ④天平 ⑤烧杯 ⑥研钵.
①漏斗 ②试管 ③蒸发皿 ④天平 ⑤烧杯 ⑥研钵.
| A. | ①③④ | B. | ①②⑥ | C. | ①③⑤ | D. | ①③⑥ |
5.下列有关胶体的叙述正确的是( )
| A. | Fe(OH)3胶体有丁达尔效应是Fe(OH)3胶体区别于FeCl3溶液最本质的特征 | |
| B. | 阳光穿透清晨的树林时形成的光柱,是胶体的丁达尔效应的体现 | |
| C. | 鸡蛋清溶液分类上属于悬浊液 | |
| D. | 向FeCl3溶液中加入NaOH溶液,会出现红褐色Fe(OH)3胶体 |
15.常温下,pH值相同的三种盐NaX、NaY和NaZ的溶液,其物质的量浓度为NaX>NaY>NaZ.下列说法正确的是( )
| A. | 三种酸的酸性为HX<HY<HZ | |
| B. | 物质的量浓度相同的三种盐的水溶液中,NaZ的溶液中,水的电离程度最大 | |
| C. | pH值相同的三种酸的水溶液,恰好中和时所耗NaOH的物质的量为HX<HY<HZ | |
| D. | 物质的量浓度相同的HZ和NaX能发生HZ+NaX=HX+NaZ |
19.下列有关实验操作或叙述正确的是( )
①医院用银氨溶液检验某病人是否患糖尿病
②乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去
③淀粉水解时应用浓硫酸作催化剂
④在鸡蛋白溶液中滴入浓HNO3,微热会产生黄色物质
⑤在植物油中滴入溴水,溴水褪色
⑥用盐析法可分离和提纯蛋白质.
①医院用银氨溶液检验某病人是否患糖尿病
②乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去
③淀粉水解时应用浓硫酸作催化剂
④在鸡蛋白溶液中滴入浓HNO3,微热会产生黄色物质
⑤在植物油中滴入溴水,溴水褪色
⑥用盐析法可分离和提纯蛋白质.
| A. | ①②③④ | B. | ②④⑤⑥ | C. | ①③⑤⑥ | D. | ①②③⑤ |
10.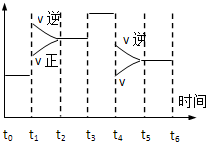 密闭体系中发生下列反应N2(g)+3H2(g)?2NH3 △H<0,如图是某一时间段中反应速率与反应进程的曲线关系图,下列各时间段内,氮气的百分含量最高的是( )
密闭体系中发生下列反应N2(g)+3H2(g)?2NH3 △H<0,如图是某一时间段中反应速率与反应进程的曲线关系图,下列各时间段内,氮气的百分含量最高的是( )
 密闭体系中发生下列反应N2(g)+3H2(g)?2NH3 △H<0,如图是某一时间段中反应速率与反应进程的曲线关系图,下列各时间段内,氮气的百分含量最高的是( )
密闭体系中发生下列反应N2(g)+3H2(g)?2NH3 △H<0,如图是某一时间段中反应速率与反应进程的曲线关系图,下列各时间段内,氮气的百分含量最高的是( )| A. | t0~t1 | B. | t2~t3 | C. | t3~t4 | D. | t5~t6 |