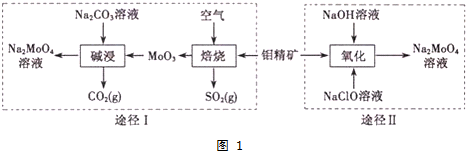
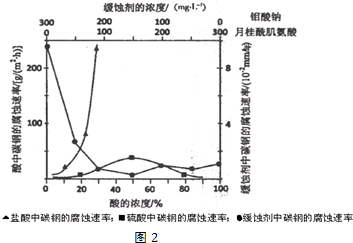
题目内容
7.下列说法正确的是( )| A. | 氧化还原反应中氧化剂和还原剂一定是两种物质 | |
| B. | 氧化还原反应中氧化产物和还原产物一定是两种物质 | |
| C. | 作氧化剂的物质一定不能作还原剂 | |
| D. | 所含元素处于中间价态时的物质,既可作氧化剂也可作还原剂 |
分析 A.氧化还原反应中,氧化剂和还原剂可以是一种物质;
B.氧化还原反应中氧化产物和还原产物可以是一种物质;
C.氧化还原反应中,作氧化剂的物质也能作还原剂;
D.处于中间价态的元素,可得到电子或失去电子.
解答 解:A.氧化还原反应中,氧化剂和还原剂可以是一种物质,如氯气与水的反应,氯气既是氧化剂又是还原剂,故A错误;
B.氧化还原反应中氧化产物和还原产物可以是一种物质,如归中反应硫化氢和二氧化硫反应生成硫和水,硫既是氧化产物和还原产物,故B错误;
C.氧化还原反应中,氧化剂和还原剂可以是一种物质,如氯气与水的反应,氯气既是氧化剂又是还原剂,所以作氧化剂的物质也能作还原剂,故C错误;
D.处于中间价态的元素,可得到电子或失去电子,则该物质可能既具有氧化性又具有还原性,如二氧化硫,故D正确;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意结合实例分析解答,题目难度不大.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
17.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1L pH=l的硫酸溶液中含有的H+数目为0.2NA | |
| B. | 1 mol羟基与l mol氢氧根离子所含质子数均为9NA | |
| C. | 14 g由N2与CO组成的混合气体中含有的原子数目为2NA | |
| D. | 标准状况下,2.24 L Cl2溶于水,转移的电子数目为0.1NA |
18.下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 弱酸性溶液中:Na+、NH4+、NO3-、Cl- | |
| B. | 无色溶液中:Fe3+、NH4+、Cl-、HS- | |
| C. | 水电离出的C(H+)=1×10-13mol•L-1的溶液中:Ca2+、HCO3-、I-、NO3- | |
| D. | 漂白粉的水溶液中:Fe2+、SO42-、Mg2+、Na+ |
15.下列各组中的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
| A. | Cu(OH)2+HC1; Cu(OH)2+CH3COOH | B. | NaHCO3+H2SO4;Na2CO3+HCl | ||
| C. | NaHS04+NaOH; H2SO4+NaOH | D. | BaCl2与 Na2SO4;Ba(OH)2 与 CuSO4 |
2.已知氢气和氧气反应生成4.5g水蒸气,同时放出60.45kJ的热量,则下列热化学方程式正确的是( )
| A. | 2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol | B. | 2H2(g)+O2(g)=2H2O(l)△H=-483.6kJ/mol | ||
| C. | 2H2(g)+O2(g)=2H2O(g)△H=-241.8kJ/mol | D. | 2H2(g)+O2(g)=2H2O(l)△H=-241.8kJ/mol |
9.硝酸生产中,500℃时,NH3和O2可能发生如下反应:
①4NH3 (g)+5O2 (g)?4NO (g)+6H2O (g);△H=-907.2kJ•mol-1 K=1.1×1026
②4NH3 (g)+4O2 (g)?2N2O (g)+6H2O (g);△H=-1104.9kJ•mol-1 K=4.4×1028
③4NH3 (g)+3O2 (g)?2N2 (g)+6H2O (g);△H=-1269.2kJ•mol-1K=7.1×1034
下列说法正确的是( )
①4NH3 (g)+5O2 (g)?4NO (g)+6H2O (g);△H=-907.2kJ•mol-1 K=1.1×1026
②4NH3 (g)+4O2 (g)?2N2O (g)+6H2O (g);△H=-1104.9kJ•mol-1 K=4.4×1028
③4NH3 (g)+3O2 (g)?2N2 (g)+6H2O (g);△H=-1269.2kJ•mol-1K=7.1×1034
下列说法正确的是( )
| A. | 增大压强,则反应的②K不变,反应①和③的K减小 | |
| B. | 500℃时,2NH3(g)+2O2 (g)?N2O (g)+3H2O (g) K=2.2×1028 | |
| C. | 500℃时,N2 (g)+O2 (g)=2NO (g)△H=+181 kJ•mol-1 | |
| D. | 500℃时,2 mol NH3 与2.5 mol O2混合发生反应①,可放出热量453.6 kJ |
10.将物质的量都为amol的金属钠和铝一同放入mg足量的水中,所得溶液的密度为ρg/cm3,则此溶液的物质的量浓度为( )
| A. | $\frac{1000ρa}{48a+m}mol/L$ | B. | $\frac{1000ρa}{46a+m}$mol/L | ||
| C. | $\frac{1000ρa}{50a+m}mol/L$ | D. | $\frac{ρa}{46a+m}mol/L$ |
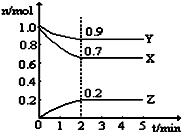 (1)反应3A(g)+B(g)═2C(g)在三种不同的条件下进行反应,在同一时间内,测得的反应速率用不同的物质表示为①vA=1 mol/(L•min)、②vC=0.5mol/(L•min)、③vB=0.5mol/(L•min),三种情况下该反应速率由大到小的关系是③>①>②.(用序号表示)
(1)反应3A(g)+B(g)═2C(g)在三种不同的条件下进行反应,在同一时间内,测得的反应速率用不同的物质表示为①vA=1 mol/(L•min)、②vC=0.5mol/(L•min)、③vB=0.5mol/(L•min),三种情况下该反应速率由大到小的关系是③>①>②.(用序号表示)