题目内容
在恒温、恒容的条件下,有反应2A(g)+2B(g)?C(g)+3D(g),现从两条途径分别建立平衡.途径Ⅰ:A、B的起始浓度均为2mol/L;途径Ⅱ:C、D的起始浓度分别为2mol/L和6mol/L.则以下叙述不正确的是( )
| A、两途径最终达到平衡时,体系内混合气的平均相对分子质量不同 | ||
| B、两途径最终达到平衡时,体系内混合气的百分组成相同 | ||
| C、达平衡时,途径Ⅰ的反应速率v(A)小于途径Ⅱ的反应速率v(A) | ||
D、达平衡时,途径Ⅰ所得混合气的密度为途径Ⅱ所得混合气密度的
|
考点:等效平衡
专题:
分析:由反应2A(g)+2B(g)?C(g)+3D(g)可知,反应前后气体的化学计量数相等,压强对平衡移动没有影响,当满足Ⅱ所加物质完全转化为A、B时,与Ⅰ物质的量比值相等,则达到等效平衡的状态.据此进行判断.
解答:
解:反应2A(g)+2B(g)?C(g)+3D(g)可知,反应前后气体的化学计量数相等,压强对平衡移动没有影响,当满足Ⅱ所加物质完全转化为A、B时,与Ⅰ物质的量比值相等,
A、途径Ⅱ与途径Ⅰ为等效平衡,平衡时各组分的含量相等,所以相对平均分子质量也相等,故A错误;
B、Ⅰ、Ⅱ两途径最终达到相同平衡状态,体系内混合气的百分组成相同,故B正确;
C、Ⅱ途径达到平衡时浓度大,压强大,反应速率应较大,故C正确;
D、Ⅰ、Ⅱ为等效平衡状态,体系内混合气体的百分组成相同,混合气体平均相对分子质量相同,由于容器体积相等,Ⅱ气体质量是Ⅰ气体质量的2倍,则达到平衡时,途径Ⅰ的气体密度为途径Ⅱ密度的
,故D正确;
故选A.
A、途径Ⅱ与途径Ⅰ为等效平衡,平衡时各组分的含量相等,所以相对平均分子质量也相等,故A错误;
B、Ⅰ、Ⅱ两途径最终达到相同平衡状态,体系内混合气的百分组成相同,故B正确;
C、Ⅱ途径达到平衡时浓度大,压强大,反应速率应较大,故C正确;
D、Ⅰ、Ⅱ为等效平衡状态,体系内混合气体的百分组成相同,混合气体平均相对分子质量相同,由于容器体积相等,Ⅱ气体质量是Ⅰ气体质量的2倍,则达到平衡时,途径Ⅰ的气体密度为途径Ⅱ密度的
| 1 |
| 2 |
故选A.
点评:本题考查等效平衡问题,题目难度中等,注意等效平衡有2种情况:①化学反应前后气体的化学计量数之和不等的反应必须满足物质的量完全相等,②反应前后气体的化学计量数相等,满足物质的量之比相等.

练习册系列答案
相关题目
在含Fe3+的溶液中加入铜粉与铁粉,充分反应后发现溶液中存在Cu2+,下列说法错误的是( )
| A、容器中已肯定无Fe粉存在 |
| B、容器中可能有Cu粉存在 |
| C、溶液中Fe2+比Cu2+多 |
| D、溶液中肯定不存在Fe3+ |
下列有关物质的性质或应用的说法中正确的是( )
| A、Si是一种非金属主族元素,其氧化物可用于制作计算机芯片 |
| B、胃穿孔患者胃酸过多时,可服用含Al(OH)3的药片 |
| C、Mg、Fe等金属在一定条件下与水反应都生成H2和对应的氢氧化物 |
| D、铝粉和氧化镁粉末混合,高温能发生铝热反应 |
取等质量的铝粉分别与足量的稀硫酸或氢氧化钠溶液反应,所得氢气的体积在同样条件下相比( )
| A、与酸反应产生的氢气多 |
| B、与碱反应产生的氢气多 |
| C、一样多 |
| D、不知道铝粉的质量,无法比较 |
已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ?mol-1
Na2O2(s)+CO2(g)═Na2CO3(s)+
O2(g)△H=-226kJ?mol-1
根据以上热化学方程式判断,下列说法正确的是( )
Na2O2(s)+CO2(g)═Na2CO3(s)+
| 1 |
| 2 |
根据以上热化学方程式判断,下列说法正确的是( )
| A、1.4g CO完全燃烧放出热量为28.3kJ |
| B、CO(g)+Na2O2(s)═Na2CO3(s)△H=-509kJ?mol-1 |
| C、2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H<-452kJ?mol-1 |
| D、CO2(g)与Na2O2(s)反应放出226kJ热量时,电子转移为2×6.02×1023 |
 如图是某公司批量生产的笔记本电脑所用的甲醇燃料电池的构造示意图.甲醇在催化剂作用下提供质子(H+)和电子,电子经过电路、质子经内电路到达另一极与氧气反应,该电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列有关该电池的说法错误的是( )
如图是某公司批量生产的笔记本电脑所用的甲醇燃料电池的构造示意图.甲醇在催化剂作用下提供质子(H+)和电子,电子经过电路、质子经内电路到达另一极与氧气反应,该电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列有关该电池的说法错误的是( )| A、右边的电极为电池的负极,b处通入的是空气 |
| B、左边的电极为电池的负极,a处通入的是甲醇 |
| C、电池负极的反应式为:2CH3OH+2H2O-12e-═2CO2↑+12H+ |
| D、电池正极的反应式为:3O2+12H++12e-═6H2O |
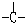 和一个-Cl,它可能的结构有四种,试写出其中的三种结构简式.
和一个-Cl,它可能的结构有四种,试写出其中的三种结构简式.