题目内容
取等质量的铝粉分别与足量的稀硫酸或氢氧化钠溶液反应,所得氢气的体积在同样条件下相比( )
| A、与酸反应产生的氢气多 |
| B、与碱反应产生的氢气多 |
| C、一样多 |
| D、不知道铝粉的质量,无法比较 |
考点:铝的化学性质
专题:元素及其化合物
分析:发生反应:2Al+3H2SO4=Al2(SO4)3+3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑,参加反应Al的质量相等,结合方程式判断.
解答:
解:分别发生反应:2Al+3H2SO4=Al2(SO4)3+3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑,参加反应Al的质量相等,由方程式可知生成氢气的体积相等,即收集氢气的体积之比为1:1,所得氢气的体积在同样条件下相比一样多,
故选C.
故选C.
点评:本题考查Al的化学性质及化学方程式的有关计算,为高频考点,侧重分析与计算能力的考查,注意等量的Al均完全反应.

练习册系列答案
相关题目
在恒温、恒容的条件下,有反应2A(g)+2B(g)?C(g)+3D(g),现从两条途径分别建立平衡.途径Ⅰ:A、B的起始浓度均为2mol/L;途径Ⅱ:C、D的起始浓度分别为2mol/L和6mol/L.则以下叙述不正确的是( )
| A、两途径最终达到平衡时,体系内混合气的平均相对分子质量不同 | ||
| B、两途径最终达到平衡时,体系内混合气的百分组成相同 | ||
| C、达平衡时,途径Ⅰ的反应速率v(A)小于途径Ⅱ的反应速率v(A) | ||
D、达平衡时,途径Ⅰ所得混合气的密度为途径Ⅱ所得混合气密度的
|
下列不饱和化合物(单体)能在一定条件下发生加聚反应生成如图所示物质的是:( )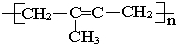
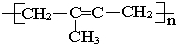
| A、丙烯 |
| B、2-甲基-1,3-丁二烯 |
| C、乙烯和丙烯 |
| D、2-甲基-2-丁烯 |
下列叙述不正确的是( )
| A、把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 |
| B、铜锌原电池工作时,电流沿外电路从铜电极流向锌电极 |
| C、把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 |
| D、为加快锌粒与盐酸反应的速率,可以向溶液中加入几滴氯化铜溶液 |
苹果汁是人们喜爱的饮料.由于饮料中含有 Fe2+离子,现榨的苹果汁在空气中会由淡绿色变为棕黄色,使Fe2+转变为Fe3+离子.若榨苹果汁时加入维生素C,可有效防止这种现象的发生.这说明维生素C具有( )
| A、氧化性 | B、还原性 |
| C、酸性 | D、碱性 |
在标准状况下,进行甲、乙、丙三组实验:三组各取60mL同浓度盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:
则下列说法正确的是( )
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 510 | 770 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
| A、甲组和乙组的实验中,盐酸均是过量的 |
| B、盐酸的物质的量浓度为0.8mol/L |
| C、合金中镁铝的物质的量之比为1:1 |
| D、丙组中铝的物质的量为0.018mol |
在一固定体积的密闭容器中,加入2mol SO2和1mol O2发生反应2SO2(g)+O2(g)?2SO3(g),达到平衡时,SO2的浓度为w mol/L.若维持容器体积和温度不变,以下列四种配比作为起始物质,达平衡后,SO2的浓度仍为w mol/L的是( )
| A、4mol SO2+2mol O2 |
| B、1mol SO2+1mol O2 |
| C、1mol SO2+1mol O2+1mol SO3 |
| D、1mol SO2+0.5mol O2+1mol SO3 |