题目内容
在含Fe3+的溶液中加入铜粉与铁粉,充分反应后发现溶液中存在Cu2+,下列说法错误的是( )
| A、容器中已肯定无Fe粉存在 |
| B、容器中可能有Cu粉存在 |
| C、溶液中Fe2+比Cu2+多 |
| D、溶液中肯定不存在Fe3+ |
考点:铁盐和亚铁盐的相互转变
专题:元素及其化合物
分析:铜和铁的还原性铁大于铜,三价铁离子先和铁反应,再和铜反应,据此解答.
解答:
解:在含Fe3+的溶液中加入铜粉与铁粉,三价铁离子先与铁反应,再与铜反应,
A.溶液中有铜离子,说明铁完全反应,故A正确;
B.如果铜过量则溶液中含有二价铁离子和铜离子,反应后剩余铜,故B正确;
C.Fe2+来自Cu与Fe3+(反应生成Cu2+与Fe2+的比例1:2),还有部分来自Fe与Fe3+反应,故Fe2+总量大于Cu2+总量,故C正确;
D.若Fe3+过量,固体完全溶解,溶液中存在Fe2+、Fe3+、Cu2+,故D错误;
故选:D.
A.溶液中有铜离子,说明铁完全反应,故A正确;
B.如果铜过量则溶液中含有二价铁离子和铜离子,反应后剩余铜,故B正确;
C.Fe2+来自Cu与Fe3+(反应生成Cu2+与Fe2+的比例1:2),还有部分来自Fe与Fe3+反应,故Fe2+总量大于Cu2+总量,故C正确;
D.若Fe3+过量,固体完全溶解,溶液中存在Fe2+、Fe3+、Cu2+,故D错误;
故选:D.
点评:本题考查氧化还原反应以及铁的单质化合物的性质,题目难度不大,把握铁与铜的还原性强弱是解题关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
150℃时,某白色固体完全分解为NH3、H2O、CO2三种物质,此时该混合气对氢气的相对密度为12.7,则( )
| A、该白色粉末为NH4HCO3 |
| B、该白色粉末为(NH4)2CO3 |
| C、该白色粉末为NH4HCO3与(NH4)2CO3 混合物且物质的量之比为1:2 |
| D、该白色粉末为NH4HCO3与(NH4)2CO3 混合物且物质的量之比为2:1 |
在恒温、恒容的条件下,有反应2A(g)+2B(g)?C(g)+3D(g),现从两条途径分别建立平衡.途径Ⅰ:A、B的起始浓度均为2mol/L;途径Ⅱ:C、D的起始浓度分别为2mol/L和6mol/L.则以下叙述不正确的是( )
| A、两途径最终达到平衡时,体系内混合气的平均相对分子质量不同 | ||
| B、两途径最终达到平衡时,体系内混合气的百分组成相同 | ||
| C、达平衡时,途径Ⅰ的反应速率v(A)小于途径Ⅱ的反应速率v(A) | ||
D、达平衡时,途径Ⅰ所得混合气的密度为途径Ⅱ所得混合气密度的
|
下列不饱和化合物(单体)能在一定条件下发生加聚反应生成如图所示物质的是:( )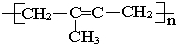
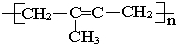
| A、丙烯 |
| B、2-甲基-1,3-丁二烯 |
| C、乙烯和丙烯 |
| D、2-甲基-2-丁烯 |
苹果汁是人们喜爱的饮料.由于饮料中含有 Fe2+离子,现榨的苹果汁在空气中会由淡绿色变为棕黄色,使Fe2+转变为Fe3+离子.若榨苹果汁时加入维生素C,可有效防止这种现象的发生.这说明维生素C具有( )
| A、氧化性 | B、还原性 |
| C、酸性 | D、碱性 |
将2mol A和1mol B充入某密闭容器中发生反应:2A(g)+B(g)?xC(g),达到化学平衡后,C的体积分数为a.假设该反应的条件分别和下列各选项的条件相同,下列判断正确的是(双选)( )
| A、若在恒温恒压下,当x=1时,按1.5 mol A、1 mol C作为起始物质,达到平衡后,C的体积分数仍为a |
| B、若在恒温恒容下,当x=2时,将2molC作起始物质,达到平衡后,C的体积分数仍为a |
| C、若在恒温恒压下,当x=3时,1mol A、1mol B、6mol C作起始物质,达到平衡后,C的体积分数仍为a |
| D、若在恒温恒容下,按0.6mol A、0.3mol B、1.4mol C作起始物质,达到平衡后,C的体积分数仍为a,则x一定为2或3 |