题目内容
18.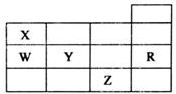 五种前四周期元素X、Y、Z、W、R在元素周期表中的位置如图所示.下列有关元素的叙述中,正确的是( )
五种前四周期元素X、Y、Z、W、R在元素周期表中的位置如图所示.下列有关元素的叙述中,正确的是( )| A. | W的简单氢化物的沸点比X的简单氢化物的沸点低 | |
| B. | 五种元素均在元素周期表的s区 | |
| C. | 电负性和第一电离能均为:Y>X>W | |
| D. | 五种元素的单质所形成的晶体类型不相同 |
分析 根据元素周期表知,X、Y、Z、W、B分别是N、S、Br、P、Ar元素,
A.氨气分子中含有氢键,导致其沸点较高;
B.五种元素位于周期表的p区;
C.P原子3p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻越大;
D.五种元素的单质形成的晶体为原子晶体.
解答 解:从图中可以看出,X为氮,Y为硫,Z为溴,W为磷,R为氩,
A.W的简单氢化物为氨气,NH3分子间形成氢键,导致其沸点较高,则沸点:NH3>PH3,故A正确;
B.N、S、Br、P、Ar元素位于元素周期表的p区,故B错误;
C.电负性应为X>Y>W,由于P原子3p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻越大,则第一电离能应为X>W>Y,故C错误;
D.N、S、Br、P、Ar的素单质形成的晶体均为分子晶体,故D错误;
故选A.
点评 本题考查原子结构与元素周期律的关系,注意利用元素的位置推断出元素是解答的关键,熟悉非金属性比较的方法及单质的性质即可解答,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.下列过程中共价键被破坏的是( )
| A. | 碘升华 | B. | 溴蒸气被木炭吸附 | ||
| C. | 食盐熔化 | D. | 电解水生成氢气和氧气 |
9.分子式为C5H10O2且可与碳酸氢钠溶液反应放出气体的有机化合物有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
6.判断以下叙述正确的是CDEF
部分短周期元素的原子半径及主要化合价
A.L2+、R2-的核外电子数相等
B.单质与稀盐酸反应的速率L<Q
C.M与T形成的化合物一定具有两性
D.氢化物的沸点为HnT>HnR
E.T与R形成的TR2、TR3均为共价化合物
F.Q与M的单质均能与盐酸、NaOH溶液反应放出氢气.
部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
B.单质与稀盐酸反应的速率L<Q
C.M与T形成的化合物一定具有两性
D.氢化物的沸点为HnT>HnR
E.T与R形成的TR2、TR3均为共价化合物
F.Q与M的单质均能与盐酸、NaOH溶液反应放出氢气.
13.苹果酸是一种常见的有机酸,其结构简式如图.苹果酸可能发生的反应是( )

①与NaOH溶液反应
②使石蕊溶液变红
③与金属钠反应放出气体
④一定条件下与乙酸发生酯化反应
⑤一定条件下与乙醇发生酯化反应.

①与NaOH溶液反应
②使石蕊溶液变红
③与金属钠反应放出气体
④一定条件下与乙酸发生酯化反应
⑤一定条件下与乙醇发生酯化反应.
| A. | ①②③ | B. | ①②③④ | C. | ①②③⑤ | D. | ①②③④⑤ |
3.有机物 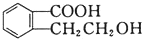 可以通过不同的反应得到①
可以通过不同的反应得到①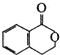 、②
、②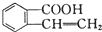 、③
、③ 三种物质.生成这三种有机物的反应类型依次为( )
三种物质.生成这三种有机物的反应类型依次为( )
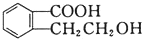 可以通过不同的反应得到①
可以通过不同的反应得到① 、②
、②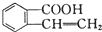 、③
、③ 三种物质.生成这三种有机物的反应类型依次为( )
三种物质.生成这三种有机物的反应类型依次为( )| A. | 酯化、取代、缩聚 | B. | 酯化、消去、缩聚 | C. | 取代、消去、加聚 | D. | 取代、消去、酯化 |
10.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,33.6LCHCl3的分子数为1.5NA | |
| B. | 4.6g乙醇含极性共价键的数目为0.8NA | |
| C. | 4.2g由C2H4和C4H8组成的混合物中含碳原子的数目为0.3NA | |
| D. | 1L0.1mol•L-1的醋酸溶液中含H+数为0.1NA |
7.下列各组两种物质在溶液中的反应,可用同一离子方程式表示的是( )
| A. | Cu(OH)2和盐酸;Cu(OH)2和CH3COOH | |
| B. | BaCl2和Na2SO4;Ba(OH)2和(NH4)2SO4 | |
| C. | NaHCO3和NaHSO4;Na2CO3和HNO3 | |
| D. | NaHCO3(过量)和Ca(OH)2;Ca(HCO3)2和NaOH(过量) |