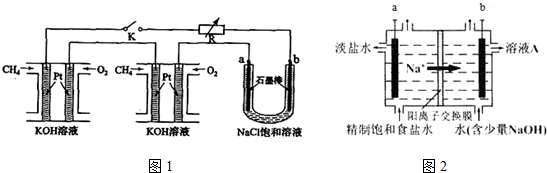
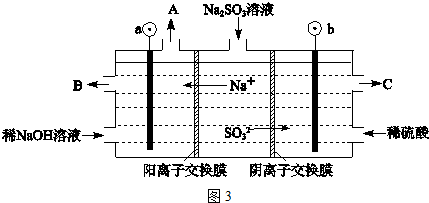
题目内容
7.下列各组两种物质在溶液中的反应,可用同一离子方程式表示的是( )| A. | Cu(OH)2和盐酸;Cu(OH)2和CH3COOH | |
| B. | BaCl2和Na2SO4;Ba(OH)2和(NH4)2SO4 | |
| C. | NaHCO3和NaHSO4;Na2CO3和HNO3 | |
| D. | NaHCO3(过量)和Ca(OH)2;Ca(HCO3)2和NaOH(过量) |
分析 A.盐酸为强酸,醋酸为弱酸,醋酸在离子反应中保留化学式;
B.BaCl2和Na2SO4反应生成硫酸钡沉淀和NaCl,Ba(OH)2和(NH4)2SO4反应生成硫酸钡和一水合氨;
C.NaHCO3与Na2CO3的阴离子不同;
D.二者均反应生成碳酸钙、碳酸钠、水.
解答 解:A.反应的离子方程式分别为:Cu(OH)2+2H+=Cu2++2H2O、Cu(OH)2+2CH3COOH=Cu2++2H2O+2CH3COO-,二者不同,故A错误;
B.前者离子反应为SO42-+Ba2+=BaSO4↓,后者离子反应为2OH-+SO42-+Ba2++2NH4+=BaSO4↓+2NH3•H2O,二者不同,故B错误;
C.NaHCO3电离出HCO3-,Na2CO3电离出CO32-,反应物不同,离子方程式不同,故C错误;
D.二者均反应生成碳酸钙、碳酸钠、水,离子反应均为2OH-+2HCO3-+Ca2+=CaCO3↓+2H2O+CO32-,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电荷守恒,题目难度不大.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
名题金卷系列答案
相关题目
17.下列反应不属于取代反应的是( )
| A. | 用氯乙烷制备乙醇 | B. | 石油裂解制丙烯 | ||
| C. | 乙醇与乙酸反应制乙酸乙酯 | D. | 油脂与浓NaOH反应制高级脂肪酸钠 |
18.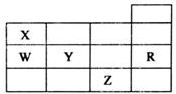 五种前四周期元素X、Y、Z、W、R在元素周期表中的位置如图所示.下列有关元素的叙述中,正确的是( )
五种前四周期元素X、Y、Z、W、R在元素周期表中的位置如图所示.下列有关元素的叙述中,正确的是( )
 五种前四周期元素X、Y、Z、W、R在元素周期表中的位置如图所示.下列有关元素的叙述中,正确的是( )
五种前四周期元素X、Y、Z、W、R在元素周期表中的位置如图所示.下列有关元素的叙述中,正确的是( )| A. | W的简单氢化物的沸点比X的简单氢化物的沸点低 | |
| B. | 五种元素均在元素周期表的s区 | |
| C. | 电负性和第一电离能均为:Y>X>W | |
| D. | 五种元素的单质所形成的晶体类型不相同 |
15.用NA表示阿伏伽德罗常数,下列叙述正确的是( )
| A. | 1molCu和足量热浓硫酸反应可生成NA个SO3分子 | |
| B. | 3mol单质Fe与足量水蒸气完全反应,失去9NA个电子 | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 22.4L的Cl2与足量水反应,转移电子数为1NA |
2.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 1mol氯气与足量水反应时转移的电子数为NA | |
| B. | 18g D2O中含有10NA个电子 | |
| C. | 50mL 18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| D. | 1mol氯气与过量铁反应时转移的电子数为2NA |
8.“绿色化学”是当今社会提出的一个新概念.在“绿色化学工艺”中,理想状态是反应物中原子全部为欲制得的产物,即原子利用率为100%.在用CH3C≡CH合成CH2=C(CH3) COOCH3的过程中,欲使原子利用率达到最高,还需要其他的反应物有( )
| A. | CO和CH3OH | B. | CO2和 H2O | C. | H2和CO2 | D. | CH3OH和H2 |
5.根据磷元素的原子结构示意图(如图所示),做出如下推理,其中与事实不符的是( )
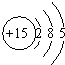
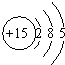
| A. | 磷元素位于元素周期表的第三周期第ⅤA族 | |
| B. | 磷元素是非金属元素 | |
| C. | 磷原子比氮原子和硫原子的得电子能力强 | |
| D. | 磷的最高价氧化物的水化物可以写成H3PO4或HPO3 |
6.关于青蒿素和双氢青蒿素(结构如图)的下列说法,错误的是( )
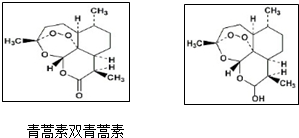

| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 由青蒿素制备双氢青蒿素的反应属还原反应 | |
| C. | 青蒿素分子中含有过氧键和酯基、醚键 | |
| D. | 双氢青蒿素分子中有2个六元环和2个七元环 |