题目内容
9.分子式为C5H10O2且可与碳酸氢钠溶液反应放出气体的有机化合物有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
分析 分子式为C5H10O2且可与碳酸氢钠溶液反应放出气体,则该有机物中含有-COOH,所以为戊酸,戊酸的种类等于丁基的种类,写出丁基的种类即可.
解答 解:分子式为C5H10O2且可与碳酸氢钠溶液反应放出气体,则该有机物中含有-COOH,所以为戊酸,戊酸的种类等于丁基的种类,丁基(-C4H9)的异构体有:-CH2CH2CH2CH3,-CH(CH3)CH2CH3,-CH2CH(CH3)CH3,-C(CH3)3,故戊酸的有机物的异构体数目为4,故选B.
点评 本题主要考查同分异构体书写、官能团的性质与确定等,难度中等,注意利用丁基异构判断.

练习册系列答案
相关题目
19. (1)氨的水溶液显弱碱性,其原因为NH3•H2O?NH4++OH-(用离子方程式表示),0.1的氨水中加入少量的NH4Cl固体,溶液的pH降低(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度增大增大(填“增大”或“减小”);
(1)氨的水溶液显弱碱性,其原因为NH3•H2O?NH4++OH-(用离子方程式表示),0.1的氨水中加入少量的NH4Cl固体,溶液的pH降低(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度增大增大(填“增大”或“减小”);
(2)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发).
①pH=13时,溶液中的c(H2S)+c(HS-)=0.0430.043mol•L-1;
②某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液pH=55时,Mn2+开始沉淀.[已知:
Ksp(MnS)=2.8×10-13].
(3)25℃,两种酸的电离平衡常数如表.
①HSO3-的电离平衡常数表达式K=$\frac{c({H}^{+})c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$;
②0.10mol•L-1Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
③H2SO3溶液和NaHCO3溶液反应的离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O;
(4)银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用.久存的银器皿表面会变黑,失去银白色的光泽,原因是Ag与空气中微量H2S反应生成黑色的Ag2S,已知Ksp(AgCl)=1.8×10-10,若向5mL0.018mol•L-1的AgNO3溶液中加入5mL0.020mol•L-1的盐酸,混合后溶液中的Ag+的浓度为1.8×10-81.8×10-8mol•L-1,pH为1.
 (1)氨的水溶液显弱碱性,其原因为NH3•H2O?NH4++OH-(用离子方程式表示),0.1的氨水中加入少量的NH4Cl固体,溶液的pH降低(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度增大增大(填“增大”或“减小”);
(1)氨的水溶液显弱碱性,其原因为NH3•H2O?NH4++OH-(用离子方程式表示),0.1的氨水中加入少量的NH4Cl固体,溶液的pH降低(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度增大增大(填“增大”或“减小”);(2)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发).
①pH=13时,溶液中的c(H2S)+c(HS-)=0.0430.043mol•L-1;
②某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液pH=55时,Mn2+开始沉淀.[已知:
Ksp(MnS)=2.8×10-13].
(3)25℃,两种酸的电离平衡常数如表.
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②0.10mol•L-1Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
③H2SO3溶液和NaHCO3溶液反应的离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O;
(4)银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用.久存的银器皿表面会变黑,失去银白色的光泽,原因是Ag与空气中微量H2S反应生成黑色的Ag2S,已知Ksp(AgCl)=1.8×10-10,若向5mL0.018mol•L-1的AgNO3溶液中加入5mL0.020mol•L-1的盐酸,混合后溶液中的Ag+的浓度为1.8×10-81.8×10-8mol•L-1,pH为1.
20.下列说法不正确的是( )
| A. | 植物油能使溴的四氯化碳溶液褪色 | |
| B. | 蛋白质、纤维素、油脂、淀粉都是高分子化合物 | |
| C. | 石油裂化、煤的干馏、铝热反应都属于化学变化 | |
| D. | 乙烯常用作水果催熟剂,乙酸常用作调味剂,乙醇常用于杀菌消毒 |
17.下列反应不属于取代反应的是( )
| A. | 用氯乙烷制备乙醇 | B. | 石油裂解制丙烯 | ||
| C. | 乙醇与乙酸反应制乙酸乙酯 | D. | 油脂与浓NaOH反应制高级脂肪酸钠 |
4.下列说法错误的是( )
| A. | 乙醇和乙酸都是常用调味品的主要成分 | |
| B. | 75%(体积分数)的乙醇溶液常用于医疗消毒 | |
| C. | 乙醇能与金属钠反应置换生成氢气 | |
| D. | 乙醇和乙酸之间能发生酯化反应,酯化反应和皂化反应互为可逆反应 |
1.化学与生活密切相关,下列有关说法错误的是( )
| A. | 油脂和蛋白质都属于高分子化合物 | |
| B. | 乙醇室温下在水中的溶解度大于溴乙烷 | |
| C. | 以液化石油气代替燃油可减少大气污染 | |
| D. | “地沟油”禁止食用,但可以用来制皂 |
18.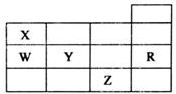 五种前四周期元素X、Y、Z、W、R在元素周期表中的位置如图所示.下列有关元素的叙述中,正确的是( )
五种前四周期元素X、Y、Z、W、R在元素周期表中的位置如图所示.下列有关元素的叙述中,正确的是( )
 五种前四周期元素X、Y、Z、W、R在元素周期表中的位置如图所示.下列有关元素的叙述中,正确的是( )
五种前四周期元素X、Y、Z、W、R在元素周期表中的位置如图所示.下列有关元素的叙述中,正确的是( )| A. | W的简单氢化物的沸点比X的简单氢化物的沸点低 | |
| B. | 五种元素均在元素周期表的s区 | |
| C. | 电负性和第一电离能均为:Y>X>W | |
| D. | 五种元素的单质所形成的晶体类型不相同 |
8.“绿色化学”是当今社会提出的一个新概念.在“绿色化学工艺”中,理想状态是反应物中原子全部为欲制得的产物,即原子利用率为100%.在用CH3C≡CH合成CH2=C(CH3) COOCH3的过程中,欲使原子利用率达到最高,还需要其他的反应物有( )
| A. | CO和CH3OH | B. | CO2和 H2O | C. | H2和CO2 | D. | CH3OH和H2 |