题目内容
3.有机物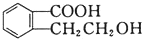 可以通过不同的反应得到①
可以通过不同的反应得到①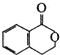 、②
、②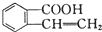 、③
、③ 三种物质.生成这三种有机物的反应类型依次为( )
三种物质.生成这三种有机物的反应类型依次为( )| A. | 酯化、取代、缩聚 | B. | 酯化、消去、缩聚 | C. | 取代、消去、加聚 | D. | 取代、消去、酯化 |
分析 得到① ,-OH与-COOH发生酯化反应;
,-OH与-COOH发生酯化反应;
得到②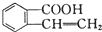 ,-OH转化为碳碳双键;
,-OH转化为碳碳双键;
得到③ ,-COOH、-OH发生缩聚反应生成高分子.
,-COOH、-OH发生缩聚反应生成高分子.
解答 解:得到① ,
,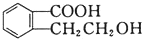 中-OH与-COOH发生酯化反应;
中-OH与-COOH发生酯化反应;
得到②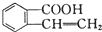 ,-OH转化为碳碳双键,则
,-OH转化为碳碳双键,则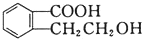 发生消去反应;
发生消去反应;
得到③ ,
,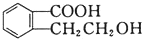 中-COOH、-OH发生缩聚反应生成高分子,
中-COOH、-OH发生缩聚反应生成高分子,
则生成这三种有机物的反应类型依次为酯化、消去、缩聚,
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意官能团变化及有机反应的应用,题目难度不大.

练习册系列答案
相关题目
13.下列物质的性质比较,正确的是( )
| A. | 酸性:H2SO4>HClO4 | B. | 碱性:NaOH>KOH | ||
| C. | 非金属性:P>S>Cl | D. | 气态氢化物稳定性:HF>HCl>H2S |
11.糖类、油脂和蛋白质是维持人体生命活动所必需的三大营养物质,下列说法不正确的是( )
| A. | 油脂水解可生成高级脂肪酸和丙三醇 | |
| B. | 淀粉水解的最终产物能与新制的Cu(OH)2悬浊液反应 | |
| C. | 淀粉和纤维素的分子式均可用(C6H10O5)n表示,他们互为同分异构体 | |
| D. | 蛋白质溶液中加入饱和硫酸铵溶液后产生的沉淀能重新溶于水 |
18.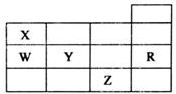 五种前四周期元素X、Y、Z、W、R在元素周期表中的位置如图所示.下列有关元素的叙述中,正确的是( )
五种前四周期元素X、Y、Z、W、R在元素周期表中的位置如图所示.下列有关元素的叙述中,正确的是( )
 五种前四周期元素X、Y、Z、W、R在元素周期表中的位置如图所示.下列有关元素的叙述中,正确的是( )
五种前四周期元素X、Y、Z、W、R在元素周期表中的位置如图所示.下列有关元素的叙述中,正确的是( )| A. | W的简单氢化物的沸点比X的简单氢化物的沸点低 | |
| B. | 五种元素均在元素周期表的s区 | |
| C. | 电负性和第一电离能均为:Y>X>W | |
| D. | 五种元素的单质所形成的晶体类型不相同 |
8.下列有关化学键的叙述,正确的是( )
| A. | 离子化合物中一定只含有离子键 | |
| B. | 单质分子中均存在化学键 | |
| C. | 仅含有共价键的化合物一定是共价化合物 | |
| D. | 由不同种非金属元素的原子形成的共价化合物一定只含极性键 |
15.用NA表示阿伏伽德罗常数,下列叙述正确的是( )
| A. | 1molCu和足量热浓硫酸反应可生成NA个SO3分子 | |
| B. | 3mol单质Fe与足量水蒸气完全反应,失去9NA个电子 | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 22.4L的Cl2与足量水反应,转移电子数为1NA |
2.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s)下列说法中错误的是( )
| A. | 电池工作时,锌失去电子,锌是负极 | |
| B. | 电池工作时,溶液中OH-向正极移动,K+、H+向负极移动 | |
| C. | 电池负极的电极反应式为:Zn-2e-+2OH-═Zn(OH)2 | |
| D. | 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |