题目内容
6.下列叙述中,能说明乙酸的酸性比碳酸强的是( )| A. | 乙酸具有挥发性 | B. | 乙酸是一元酸 | ||
| C. | 乙酸是有机酸而碳酸是无机酸 | D. | 乙酸能与碳酸氢钠反应放出CO2 |
分析 酸的酸性越强其电离程度越大,强酸能和弱酸盐反应生成弱酸,据此分析解答.
解答 解:A.乙酸具有挥发性,不能判断乙酸酸性比碳酸强,具有挥发性的酸也可能是强酸,如盐酸和硝酸等,故A错误;
B.酸的强弱与其电离程度有关,与酸的元数无关,故B错误;
C.酸的相对强弱与有机酸、无机酸无关,与其电离程度有关,故C错误;
D.乙酸能和碳酸氢钠反应生成二氧化碳,根据强酸制取弱酸知,乙酸酸性大于碳酸,故D正确;
故选D.
点评 本题考查酸的酸性强弱比较,为高频考点,侧重考查学生分析判断能力,利用强酸制取弱酸规律来分析解答即可,注意:酸的强弱与酸的元数及溶解度都无关,题目难度不大.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案
相关题目
7. 钍试剂滴定法测定烟气中SO3、SO2含量的装置如图所示.
钍试剂滴定法测定烟气中SO3、SO2含量的装置如图所示.
当通过1m3烟气时,将吸收瓶1中的吸收液转移至锥形瓶1中,加入1~3滴钍指示剂,以0.025 00mol•L-1的Ba(ClO4)2标准液滴定至终点,消耗Ba(ClO4)2溶液20.00mL;将吸收瓶2、3中的吸收液转移至1 000mL容量瓶中并定容,取50.00mL至锥形瓶2中,加入40mL异丙醇,加入1~3滴钍指示剂,以0.025 00mol•L-1的Ba(ClO4)2标准液滴定至终点,消耗Ba(ClO4)2溶液30.00mL[已知:Ba(ClO4)2+H2SO4═BaSO4↓+2HClO4].
(1)将吸收瓶放入冰水箱中的目的是降温,增大气体的溶解度,使SO2、SO3易被吸收.
(2)100g 6.8%(质量分数)的H2O2溶液最多能吸收4.48 L(标准状况)SO2.
(3)当溶液中SO42-完全沉淀[c(SO42-)≤1.0×10-6 mol•L-1]时,c(Ba2+)≥1.1×10-4 mol/L[室温下,Ksp(BaSO4)=1.1×10-10].
(4)根据以上数据计算烟气中SO3、SO2的质量浓度ρρ(SO3)=40 mg•m-3,ρ(SO2)=960 mg•m-3(mg•m-3)(请给出计算过程).
 钍试剂滴定法测定烟气中SO3、SO2含量的装置如图所示.
钍试剂滴定法测定烟气中SO3、SO2含量的装置如图所示.| 吸收瓶 | 1 | 2 | 3 |
| 试剂 | 50mL | ||
| 异丙醇 | 50mL 6.8% | ||
| H2O2溶液 | 50mL 6.8% | ||
| H2O2溶液 | |||
| 目的 | 吸收SO3 | 吸收SO2 |
(1)将吸收瓶放入冰水箱中的目的是降温,增大气体的溶解度,使SO2、SO3易被吸收.
(2)100g 6.8%(质量分数)的H2O2溶液最多能吸收4.48 L(标准状况)SO2.
(3)当溶液中SO42-完全沉淀[c(SO42-)≤1.0×10-6 mol•L-1]时,c(Ba2+)≥1.1×10-4 mol/L[室温下,Ksp(BaSO4)=1.1×10-10].
(4)根据以上数据计算烟气中SO3、SO2的质量浓度ρρ(SO3)=40 mg•m-3,ρ(SO2)=960 mg•m-3(mg•m-3)(请给出计算过程).
8.设NA为阿伏加德罗常数的值,下列说法的是( )
| A. | 42g环丙烷和丙烯的混合气体中氢原了数目一定为6NA | |
| B. | 1L 0.1mol/L的NH4NO3溶液中原子数少于0.2NA | |
| C. | 在常温常压下,22.4LHF所含分子数为NA | |
| D. | 5.6gFe与足量的水蒸气完全反应,转移电子的数目为0.2NA |
14.下列说法正确的是( )
| A. | 一定温度下,将氨水稀释,NH3?H2O 的电离度增大,H2O 的电离度也增大 | |
| B. | 水中加酸加碱都会阻碍水的电离,所以 c(H+)?c(OH-)<10-14 | |
| C. | 水中加酸,阻碍水的电离,所以 c(H+)=c(OH-)<10-7 mol•L-1 | |
| D. | 醋酸溶液加水稀释,溶液中所有微粒的浓度都会降低 |
11.下列关于各图象的解释或结论正确的是( )
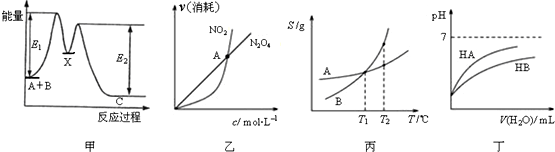

| A. | 由甲可知:加入催化剂可改变反应A+B→C的焓变 | |
| B. | 由乙可知:对于恒温恒容条件下的反应2NO2(g)?N2O4(g),A点为平衡状态 | |
| C. | 由丙可知:将A、B饱和溶液分别由T1℃升温至T2℃时,溶质的质量分数B>A | |
| D. | 由丁可知:相同温度、相同浓度的HA溶液与HB溶液相比,其pH前者小于后者 |
18.室温下,将10mLpH=3的醋酸溶液加水稀释后,下列说法不正确是( )
| A. | 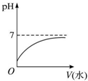 | |
| B. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变 | |
| C. | 溶液中导电粒子的数目增加 | |
| D. | 再加入10 mL pH=11的NaOH溶液,恰好完全中和 |
16.下列各反应式中正确的是( )
| A. | 用稀HNO3溶解Fe3O4固体的离子方程式:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| B. | 将SO2通入H2S溶液中的化学方程式:SO2+2H2S═3S+2H2O | |
| C. | 氢溴酸与氢氧化钠发生中和反应的离子方程式:H++OH-═H2O | |
| D. | 向明矾溶液中加入过量的氨水发生反应的离子方程式:Al3++4OH-═${AlO}_{2}^{-}$+2H2O |