题目内容
16.下列各反应式中正确的是( )| A. | 用稀HNO3溶解Fe3O4固体的离子方程式:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| B. | 将SO2通入H2S溶液中的化学方程式:SO2+2H2S═3S+2H2O | |
| C. | 氢溴酸与氢氧化钠发生中和反应的离子方程式:H++OH-═H2O | |
| D. | 向明矾溶液中加入过量的氨水发生反应的离子方程式:Al3++4OH-═${AlO}_{2}^{-}$+2H2O |
分析 A.硝酸具有强的氧化性,能够氧化二价铁离子生成三价铁离子;
B.二者反应生成硫单质和水,硫不溶液水是沉淀;
C.二者反应生成氢离子与氢氧根离子反应生成水;
D.不符合反应客观事实.
解答 解:A.HNO3会将Fe3O4中的+2价Fe氧化成+3价,稀 HNO3被还原为NO,应写为3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O,故A错误;
B.将SO2通入H2S溶液中的化学方程式:SO2+2H2S═3S↓+2H2O,故B错误;
C.氢溴酸与氢氧化钠发生中和反应的离子方程式:H++OH-═H2O,故C正确;
D.向明矾溶液中加入过量的氨水发生反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意氢氧化铝只能溶解在强碱溶液中,注意化学符合使用的规范性,题目难度不大.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案
相关题目
6.下列叙述中,能说明乙酸的酸性比碳酸强的是( )
| A. | 乙酸具有挥发性 | B. | 乙酸是一元酸 | ||
| C. | 乙酸是有机酸而碳酸是无机酸 | D. | 乙酸能与碳酸氢钠反应放出CO2 |
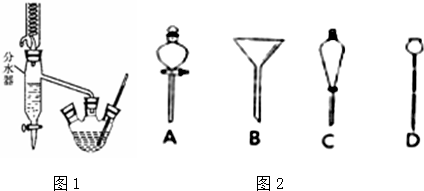
7.用固体样品配制一定物质的量浓度的溶液,需经过溶解、转移、定容、摇匀等操作.下列图示对应的操作不规范的是( )
| A. |  溶解 | B. |  转移 | C. |  定容 | D. |  摇匀 |
11.下列离子方程式书写正确的是( )
| A. | 向Na2S溶液中加入少量的氯化银:S2-+2Ag+═Ag2S↓ | |
| B. | 向滴有酚酞的1 mol/L硅酸钠溶液中加入稀盐酸至溶液红色消失:SiO${\;}_{3}^{2-}$+2H+═H2SiO3(胶体) | |
| C. | 碳酸氢铵溶液中加入足量NaOH:HCO${\;}_{3}^{-}$+OH-═CO${\;}_{3}^{2-}$+H2O | |
| D. | 向苯酚钠溶液中通入一定量CO2: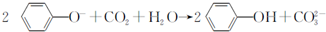 |
1.实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如表:
操作如下:
①在50mL三颈烧瓶中,加入18.5mL正丁醇和13.4mL冰醋酸,3~4滴浓硫酸,投入沸石.安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管.
②将分水器分出的酯层和反应液一起倒入分液漏斗中,水洗,10% Na2CO3洗涤,再水洗,最后转移至锥形瓶,干燥.
③将干燥后的乙酸正丁酯滤入烧瓶中,常压蒸馏,收集馏分,得15.1g乙酸正丁酯.
请回答有关问题:
(1)冷水应该从冷凝管a(填a或b)端管口通入.
(2)仪器A中发生反应的化学方程式为CH3COOH+CH3CH2CH2CH2OH CH3COOCH2CH2CH2CH3+H2O.
CH3COOCH2CH2CH2CH3+H2O.
(3)步骤①“不断分离除去反应生成的水”该操作的目的是:使用分水器分离出水,使平衡正向移动,提高反应产率.
(4)步骤②中用10%Na2CO3溶液洗涤有机层,该步操作的目的是除去产品中含有的乙酸等杂质.
(5)进行分液操作时,使用的漏斗是C(填选项).
(6)步骤③在进行蒸馏操作时,若从118℃开始收集馏分,产率偏高(填“高”或者“低”)原因是会收集到少量未反应的冰醋酸和正丁醇
(7)该实验过程中,生成乙酸正丁酯的产率是65%.
| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点,/℃ | 溶解度/l00g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
①在50mL三颈烧瓶中,加入18.5mL正丁醇和13.4mL冰醋酸,3~4滴浓硫酸,投入沸石.安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管.
②将分水器分出的酯层和反应液一起倒入分液漏斗中,水洗,10% Na2CO3洗涤,再水洗,最后转移至锥形瓶,干燥.
③将干燥后的乙酸正丁酯滤入烧瓶中,常压蒸馏,收集馏分,得15.1g乙酸正丁酯.

请回答有关问题:
(1)冷水应该从冷凝管a(填a或b)端管口通入.
(2)仪器A中发生反应的化学方程式为CH3COOH+CH3CH2CH2CH2OH
 CH3COOCH2CH2CH2CH3+H2O.
CH3COOCH2CH2CH2CH3+H2O.(3)步骤①“不断分离除去反应生成的水”该操作的目的是:使用分水器分离出水,使平衡正向移动,提高反应产率.
(4)步骤②中用10%Na2CO3溶液洗涤有机层,该步操作的目的是除去产品中含有的乙酸等杂质.
(5)进行分液操作时,使用的漏斗是C(填选项).
(6)步骤③在进行蒸馏操作时,若从118℃开始收集馏分,产率偏高(填“高”或者“低”)原因是会收集到少量未反应的冰醋酸和正丁醇
(7)该实验过程中,生成乙酸正丁酯的产率是65%.
5.下列各组物质,前者属于电解质,后者属于非电解质的是( )
| A. | NaCl晶体、BaSO4 | B. | 铝、二氧化硫 | ||
| C. | 液态的醋酸、酒精 | D. | 熔融的KNO3、硫酸溶液 |
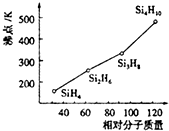 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.
太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.