题目内容
8.设NA为阿伏加德罗常数的值,下列说法的是( )| A. | 42g环丙烷和丙烯的混合气体中氢原了数目一定为6NA | |
| B. | 1L 0.1mol/L的NH4NO3溶液中原子数少于0.2NA | |
| C. | 在常温常压下,22.4LHF所含分子数为NA | |
| D. | 5.6gFe与足量的水蒸气完全反应,转移电子的数目为0.2NA |
分析 A.环丙烷和丙烯是同分异构体,二者分子式都是C3H6,42g混合物中n(C3H6)=$\frac{42g}{42g/mol}$=1mol,每个分子中都含有6个H原子,据此氢原子总数;
B.n(NH4NO3)=0.1mol/L×1L=0.1mol,该溶液中的原子不含硝酸铵和水中的;
C.常温常压下,气体摩尔体积大于22.4L/mol;
D.铁和水蒸气反应生成Fe3O4,根据Fe和转移电子之间的关系式计算转移电子数.
解答 解:A.环丙烷和丙烯是同分异构体,二者分子式都是C3H6,42g混合物中n(C3H6)=$\frac{42g}{42g/mol}$=1mol,每个分子中都含有6个H原子,所以氢原子总数为6NA,故A正确;
B.n(NH4NO3)=0.1mol/L×1L=0.1mol,该溶液中的原子不含硝酸铵和水中的,所以原子总数大于0.2NA,故B错误;
C.常温常压下,气体摩尔体积大于22.4L/mol,22.4LHF的物质的量小于1mol,则分子总数小于NA,故C错误;
D.n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,铁和水蒸气反应生成Fe3O4,该反应中Fe元素化合价由0价变为+$\frac{8}{3}$价,所以5.6gFe完全反应转移电子数=0.1mol×$\frac{8}{3}$×NA/mol=$\frac{4}{15}$NA,故D错误;
故选A.
点评 本题考查物质的量有关计算,为高频考点,涉及同分异构体、气体摩尔体积、氧化还原反应、物质构成等知识点,明确气体摩尔体积适用范围及其适用条件、氧化还原反应特点等知识点是解本题关键,易错选项是CD.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
19.已知氮气和氧气发生化合反应的能量变化图象如图所示.下列推断正确的是( )
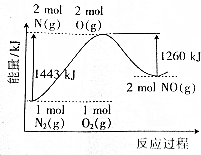

| A. | 氮气和氧气的反应是氧化还原反应,也是放热反应 | |
| B. | 1molNO分子被拆成原子要放出630kJ能量 | |
| C. | 1molN2(g)和1molO2(g)完全反应生成2molNO(g)时吸收183kJ能量 | |
| D. | 在酒精灯加热条件下,N2和O2能发生化合反应生成NO |
16.下面是几位同学在检验溴乙烷中含有溴元素的记录,其中正确的是( )
| A. | 溴乙烷$\stackrel{AgNO_{3}溶液}{→}$浅黄↓ | |
| B. | 溴乙烷$→_{HNO_{3}}^{AgNO_{3}}$浅黄↓ | |
| C. | 溴乙烷$→_{△}^{NaOH和水}$$→_{AgNO_{3}溶液}^{HNO_{3}}$浅黄↓ | |
| D. | 溴乙烷$→_{△}^{NaOH和乙醇}$$\stackrel{AgNO_{3}溶液}{→}$浅黄↓ |
6.下列叙述中,能说明乙酸的酸性比碳酸强的是( )
| A. | 乙酸具有挥发性 | B. | 乙酸是一元酸 | ||
| C. | 乙酸是有机酸而碳酸是无机酸 | D. | 乙酸能与碳酸氢钠反应放出CO2 |
7.用固体样品配制一定物质的量浓度的溶液,需经过溶解、转移、定容、摇匀等操作.下列图示对应的操作不规范的是( )
| A. | 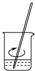 溶解 | B. |  转移 | C. |  定容 | D. | 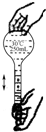 摇匀 |