题目内容
1.现有浓度均为0.1mol•L -1 的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵⑤醋酸铵 ⑥硫酸氢铵 ⑦氨水,请回答下列问题:(1)已知t℃时,Kw=1×10-13,则t℃>25℃(填“>”“<”或“=”).在t℃时将pH=11的NaOH溶液a L 与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a:b=9:2.
(2)④、⑤、⑥、⑦四种溶液中NH4+浓度由大到小的顺序是⑥④⑤⑦(填序号).
(3)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①(填序号).
(4)①、②、③、④、⑤五种溶液,能促进水的电离的是④、⑤(填序号).
分析 (1)水的电离是吸热反应,升高温度促进水电离,水的离子积常数增大;pH=11的NaOH溶液中c(OH-)=0.01mol/L、pH=1的硫酸中c(H+)=0.1mol/L,二者混合后pH=2,溶液呈酸性,混合溶液中c(H+)=0.01mol/L,则混合溶液中c(H+)=$\frac{0.1mol/L×bL-0.01mol/L×aL}{(a+b)L}$;
(2)化学式中铵根离子个数相等的强电解质中,醋酸根离子促进铵根离子水解,氢离子抑制铵根离子水解,一水合氨是弱电解质,其电离程度较小;
(3)酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中氢离子浓度越大或碱中氢氧根离子浓度越大,其抑制水电离程度越大;
(4)酸、强酸酸式盐或碱抑制水电离,含有弱离子的盐促进水电离.
解答 解:(1)水的电离是吸热反应,升高温度促进水电离,水的离子积常数增大,该温度下离子积常数大于20℃时的离子积常数,所以该温度大于25℃;pH=11的NaOH溶液中c(OH-)=0.01mol/L、pH=1的硫酸中c(H+)=0.1mol/L,二者混合后pH=2,溶液呈酸性,混合溶液中c(H+)=0.01mol/L,则混合溶液中c(H+)=$\frac{0.1mol/L×bL-0.01mol/L×aL}{(a+b)L}$=0.01mol/L,a:b=9:2,故答案为:>;9:2;
(2)化学式中铵根离子个数相等的强电解质中,醋酸根离子促进铵根离子水解,氢离子抑制铵根离子水解,一水合氨是弱电解质,其电离程度较小,所以等浓度的这几种溶液中,铵根离子浓度大小顺序是⑥④⑤⑦,故答案为:⑥④⑤⑦;
(3)酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中氢离子浓度越大或碱中氢氧根离子浓度越大,其抑制水电离程度越大,等浓度的这几种溶液中,NH4Cl促进水电离,H2SO4中氢离子浓度是0.2mol/L、醋酸中氢离子浓度小于0.1mol/L、NaOH中氢氧根离子浓度为0.1mol/L,所以①.②.③.④四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①,故答案为:④②③①;
(4)酸、强酸酸式盐或碱抑制水电离,含有弱离子的盐促进水电离,①②是酸、③是碱,这三种物质都抑制水电离,④⑤是含有弱离子的盐,都促进水电离,
故答案为:④、⑤.
点评 本题考查弱电解质的电离及盐类水解,为高频考点,明确弱电解质电离特点及水电离影响因素是解本题关键,侧重考查学生分析判断及总结归纳能力,知道哪些物质促进水电离、哪些物质抑制水电离,题目难度不大.

 快乐5加2金卷系列答案
快乐5加2金卷系列答案(1)早期冶炼金属锰的一种方法是先煅烧软锰矿生成Mn3O4,再利用铝热反应原理制得锰,该铝热反应的化学方程式为8Al+3Mn3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Mn.
(2)现代冶炼金属锰的一种工艺流程如图所示:

表为t℃时,有关物质的pKsp(注:pKsp=-lgKsp).
| 物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKsp | 37.4 | 19.32 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
①该反应中,还原剂为C6H12O6.写出一种能提高还原浸出速率的措施:升高反应温度.
②滤液1的pH>(填“>”、“<”或“=”)MnSO4浸出液的pH.
③加入MnF2的主要目的是除去Ca2+(填Ca2+、Fe3+或Cu2+)
(3)由MnSO4制取MnCO3
往MnSO4溶液中加入过量NH4HCO3溶液,该反应的离子方程式为Mn2++2HCO3-=MnCO3↓+H2O+CO2↑;若往MnSO4溶液中加入(NH4)2CO3溶液,还会产生Mn(OH)2,可能的原因有:MnCO3(s)+2OH-(aq)?Mn(OH)2(s)+CO32-(aq),t℃时,计算该反应的平衡常数K=100(填数值).
| A. | 乙酸具有挥发性 | B. | 乙酸是一元酸 | ||
| C. | 乙酸是有机酸而碳酸是无机酸 | D. | 乙酸能与碳酸氢钠反应放出CO2 |
 某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )| A. | 水电离程度d<a<b<c | |
| B. | b点溶液的导电性比c点溶液的导电性弱 | |
| C. | a点KW的数值比c点KW的数值大 | |
| D. | b点酸的总浓度大于a点酸的总浓度 |
 常温下有下列四种溶液:
常温下有下列四种溶液:| 序号 | ① | ② | ③ | ④ |
| 溶液 | pH=4的NH4Cl溶液 | pH=4的盐酸 | 0.1mol•L-1的醋酸溶液 | 0.1mol•L-1的NaOH溶液 |
请回答下列问题:
(1)用④的标准液滴定③宜选用酚酞(填“石蕊”、“酚酞”或“四基橙”)作为指示剂,①和②两种溶液中由水电离出的c(H+)之比为106:1,
(2)都是0.1mol/L的①NH4Cl②NH4HCO3③CH3COONH4 ④NH4HSO4的溶液中NH4+离子浓度大小顺序为④>①>③>②.(用序号填空)
(3)取溶液③滴定20mL溶液④,滴定曲线如图所示,则a点时溶液中各离子浓度的大小关系为c(Na+)>c(OH-)>c(CH3COO-)>c(H+);若b点时消耗③的体积为V mL,则V>20(填“>”、“<”或“=”).
| A. | 向Na2S溶液中加入少量的氯化银:S2-+2Ag+═Ag2S↓ | |
| B. | 向滴有酚酞的1 mol/L硅酸钠溶液中加入稀盐酸至溶液红色消失:SiO${\;}_{3}^{2-}$+2H+═H2SiO3(胶体) | |
| C. | 碳酸氢铵溶液中加入足量NaOH:HCO${\;}_{3}^{-}$+OH-═CO${\;}_{3}^{2-}$+H2O | |
| D. | 向苯酚钠溶液中通入一定量CO2: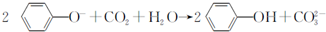 |