题目内容
7. 钍试剂滴定法测定烟气中SO3、SO2含量的装置如图所示.
钍试剂滴定法测定烟气中SO3、SO2含量的装置如图所示.| 吸收瓶 | 1 | 2 | 3 |
| 试剂 | 50mL | ||
| 异丙醇 | 50mL 6.8% | ||
| H2O2溶液 | 50mL 6.8% | ||
| H2O2溶液 | |||
| 目的 | 吸收SO3 | 吸收SO2 |
(1)将吸收瓶放入冰水箱中的目的是降温,增大气体的溶解度,使SO2、SO3易被吸收.
(2)100g 6.8%(质量分数)的H2O2溶液最多能吸收4.48 L(标准状况)SO2.
(3)当溶液中SO42-完全沉淀[c(SO42-)≤1.0×10-6 mol•L-1]时,c(Ba2+)≥1.1×10-4 mol/L[室温下,Ksp(BaSO4)=1.1×10-10].
(4)根据以上数据计算烟气中SO3、SO2的质量浓度ρρ(SO3)=40 mg•m-3,ρ(SO2)=960 mg•m-3(mg•m-3)(请给出计算过程).
分析 (1)降低温度,增大气体溶解度,有利于二氧化硫、三氧化硫的吸收;
(2)发生反应:H2O2+SO2=H2SO4,计算溶液中H2O2的质量,结合方程式计算二氧化硫的体积;
(3)Ksp(BaSO4)=c(SO42-)×c(Ba2+)=1.1×10-10计算;
(4)吸收瓶1吸收SO3,根据S原子守恒可知n(SO3)=n[Ba(ClO4)2]1,吸收瓶2、3吸收SO2,根据S原子守恒可知n(SO2)=n[Ba(ClO4)2]2,进而计算质量浓度.
解答 解:(1)将吸收瓶放入冰水箱中,可以降温,增大气体的溶解度,使SO2、SO3易被吸收,
故答案为:降温,增大气体的溶解度,使SO2、SO3易被吸收;
(2)设标况下最多能吸收二氧化硫的体积为V,则:
H2O2+SO2=H2SO4
34g 22.4L
100g×6.8% V
所以V=$\frac{100g×6.8%×22.4L}{34g}$=4.48L
故答案为:4.48;
(3)当溶液中SO42-完全沉淀时c(SO42-)≤1.0×10-6 mol•L-1,Ksp(BaSO4)=c(SO42-)×c(Ba2+)=1.1×10-10,则c(Ba2+)≥$\frac{1.1×1{0}^{-10}}{1.0×1{0}^{-6}}$mol/L=1.1×10-4 mol/L,
故答案为:1.1×10-4 mol/L;
(4)吸收瓶1吸收SO3,根据S原子守恒可知n(SO3)=n[Ba(ClO4)2]1=0.025 00 mol•L-1×0.020 00 L=5.000×10-4 mol,
ρ(SO3)=(5.000×10-4 mol×80 g•mol-1×103 mg•g-1)/1 m3=40 mg•m-3;
吸收瓶2、3吸收SO2,根据S原子守恒可知n(SO2)=n[Ba(ClO4)2]2=0.025 00 mol•L-1×0.030 00 L×$\frac{1000mL}{50.00mL}$=0.015 00 mol,
ρ(SO2)=(0.015 00 mol×64 g•mol-1×103 mg•g-1)/1 m3=960 mg•m-3,
故答案为:ρ(SO3)=40 mg•m-3,ρ(SO2)=960 mg•m-3.
点评 本题考查物质含量测定、化学方程式计算、溶度积有关计算,题目素材陌生,易使学生产生畏惧感,侧重考查分析计算能力.

| A. | 若原料完全反应成上述产物,CH3CH2Br与NH3的物质的量之比为2:1 | |
| B. | CH3CH2Br和HBr均属于电解质 | |
| C. | 该反应属于取代反应 | |
| D. | CH3CH2Br难溶于水 |
(1)早期冶炼金属锰的一种方法是先煅烧软锰矿生成Mn3O4,再利用铝热反应原理制得锰,该铝热反应的化学方程式为8Al+3Mn3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Mn.
(2)现代冶炼金属锰的一种工艺流程如图所示:

表为t℃时,有关物质的pKsp(注:pKsp=-lgKsp).
| 物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKsp | 37.4 | 19.32 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
①该反应中,还原剂为C6H12O6.写出一种能提高还原浸出速率的措施:升高反应温度.
②滤液1的pH>(填“>”、“<”或“=”)MnSO4浸出液的pH.
③加入MnF2的主要目的是除去Ca2+(填Ca2+、Fe3+或Cu2+)
(3)由MnSO4制取MnCO3
往MnSO4溶液中加入过量NH4HCO3溶液,该反应的离子方程式为Mn2++2HCO3-=MnCO3↓+H2O+CO2↑;若往MnSO4溶液中加入(NH4)2CO3溶液,还会产生Mn(OH)2,可能的原因有:MnCO3(s)+2OH-(aq)?Mn(OH)2(s)+CO32-(aq),t℃时,计算该反应的平衡常数K=100(填数值).
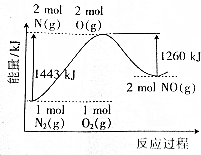
| A. | 氮气和氧气的反应是氧化还原反应,也是放热反应 | |
| B. | 1molNO分子被拆成原子要放出630kJ能量 | |
| C. | 1molN2(g)和1molO2(g)完全反应生成2molNO(g)时吸收183kJ能量 | |
| D. | 在酒精灯加热条件下,N2和O2能发生化合反应生成NO |
| A. | 溴乙烷$\stackrel{AgNO_{3}溶液}{→}$浅黄↓ | |
| B. | 溴乙烷$→_{HNO_{3}}^{AgNO_{3}}$浅黄↓ | |
| C. | 溴乙烷$→_{△}^{NaOH和水}$$→_{AgNO_{3}溶液}^{HNO_{3}}$浅黄↓ | |
| D. | 溴乙烷$→_{△}^{NaOH和乙醇}$$\stackrel{AgNO_{3}溶液}{→}$浅黄↓ |
| A. | 乙酸具有挥发性 | B. | 乙酸是一元酸 | ||
| C. | 乙酸是有机酸而碳酸是无机酸 | D. | 乙酸能与碳酸氢钠反应放出CO2 |
 .
.