题目内容
如图所示,关于该装置的下列叙述中,不正确的是( )
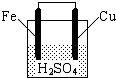

| A、铁棒是负极,发生氧化反应 |
| B、铜棒上有气体放出 |
| C、电流从锌片经导线流向铜片 |
| D、电池总反应方程式可表示为:Fe+2H+=Fe2++H2↑ |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:Fe比铜Cu活泼,形成原电池反应时,Fe为负极,Cu为正极,负极发生氧化反应,正极发生还原反应,原电池中电子从负极流向正极,以此解答该题.
解答:
解:A.铁比铜活泼,为原电池的负极,发生氧化反应,故A正确;
B.铜为正极,电极方程式为2H++e-=H2↑,故B正确;
C.原电池中电子从负极流向正极,则电子从锌片经导线流向铜片,电流的流向与电子相反,故C错误;
D.电池总反应为铁置换出氢气的反应,总方程式可表示为:Fe+2H+=Fe2++H2↑,故D正确.
故选C.
B.铜为正极,电极方程式为2H++e-=H2↑,故B正确;
C.原电池中电子从负极流向正极,则电子从锌片经导线流向铜片,电流的流向与电子相反,故C错误;
D.电池总反应为铁置换出氢气的反应,总方程式可表示为:Fe+2H+=Fe2++H2↑,故D正确.
故选C.
点评:本题考查原电池知识,侧重于基本理论知识的综合理解和运用的考查,注意把握原电池的工作原理,难度不大.

练习册系列答案
相关题目
下列离子方程式正确的是( )
| A、FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O | ||||
| B、过量石灰水与碳酸氢钙反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | ||||
C、H
| ||||
| D、向氯化铝溶液中滴加过量氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
下列说法中正确的是( )
| A、在化学反应过程中,发生物质变化的同时不一定发生能量变化 |
| B、生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为吸热反应 |
| C、反应产物的总能量大于反应物的总能量时,△H>0 |
| D、△H的大小与热化学方程式的计量系数无关 |
下列叙述正确的是( )
| A、1.00molNaCl中含有6.02×1023个NaCl分子 |
| B、欲配置1.00L1.00mol/L的NaCl溶液,可将58.5gNaCl溶于1.00L水中 |
| C、1molNO2和N2O4混合气体中含有原子总数为3NA |
| D、1molNa与足量的O2反应,生成Na2O和Na2O2的混合物,共转移NA个电子 |
有关3BrF3+5H2O═HBrO3+Br2+9HF+O2↑反应的叙述中,正确的是( )
| A、还原剂和氧化剂的物质的量之比为5:3 |
| B、HBrO3和HF是还原产物 |
| C、生成1molO2,转移4mol电子 |
| D、BrF3既是氧化剂,又是还原剂 |
下列事实不能用勒夏特列原理来解释的是( )
| A、加压有利于SO2与O2反应生成SO3 |
| B、用过量空气煅烧硫铁矿可以提高原料的利用率 |
| C、加入催化剂都能使合成氨的反应速率加快 |
| D、温度过高对合成氨反应不利 |
已知25℃时有关弱酸的电离平衡常数:则下列有关说法不正确的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 | HClO |
| 电离常数K(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 | 2.95×10-8 |
| A、amol/L的氯水溶液中,C(H+)<C(Cl-)+C(HClO)+C(OH-) |
| B、等物质的量浓度的各溶液pH关系为:PH(NaCN)>PH(NaClO)>PH(Na2CO3)>PH(CH3COONa) |
| C、0.1mol/L醋酸中逐滴加水,则醋酸的电离程度增大,C(H+)、C(CH3COO-)减小,C(OH-)增大 |
| D、NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)>c(OH-)+c(HCO3-)+c(CO32-) |
下列各实验装置图与操作正确且能达到实验目的( )
A、 实验室干燥氯气 |
B、 实验室收集SO2气体 |
C、 稀释浓硫酸 |
D、 鉴定Fe3+ |