题目内容
下列事实不能用勒夏特列原理来解释的是( )
| A、加压有利于SO2与O2反应生成SO3 |
| B、用过量空气煅烧硫铁矿可以提高原料的利用率 |
| C、加入催化剂都能使合成氨的反应速率加快 |
| D、温度过高对合成氨反应不利 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:首先明确勒夏特列原理是判断影响平衡移动的因素的改变对平衡移动的影响,如果条件改变不影响平衡移动就不能用其解释.
解答:
解:A、加压能够使二氧化硫的催化氧化向条件减小的正反应方向移动,故A正确;
B、过量空气能够使反应物更多的转化为生成物,故B正确;
C、催化剂不影响平衡移动,故C错误;
D、合成氨是吸热反应,温度过高使平衡向吸热的逆向移动,故D正确;
故选C.
B、过量空气能够使反应物更多的转化为生成物,故B正确;
C、催化剂不影响平衡移动,故C错误;
D、合成氨是吸热反应,温度过高使平衡向吸热的逆向移动,故D正确;
故选C.
点评:本题考查了勒夏特列原理的利用,注意影响平衡移动的因素只有温度、浓度、压强.

练习册系列答案
相关题目
100℃时,Kw=1×10-12,将100℃时pH=10的NaOH溶液和pH=1的H2SO4混合,所得混合溶液的pH=2,则NaOH溶液和H2SO4溶液的体积比是( )
| A、11:1 | B、9:2 |
| C、12:11 | D、9:1 |
 乙醇分子结构中各种化学键如图所示,关于乙醇在各种反应中断裂键的说明不正确的是( )
乙醇分子结构中各种化学键如图所示,关于乙醇在各种反应中断裂键的说明不正确的是( )| A、和金属钠作用时,键①断裂 |
| B、和浓硫酸共热至170℃时,②键和⑤断裂 |
| C、在铜催化下和氧气反应时,键①和③断裂 |
| D、与氢卤酸反应时,①键断裂 |
如图所示,关于该装置的下列叙述中,不正确的是( )
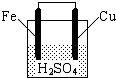

| A、铁棒是负极,发生氧化反应 |
| B、铜棒上有气体放出 |
| C、电流从锌片经导线流向铜片 |
| D、电池总反应方程式可表示为:Fe+2H+=Fe2++H2↑ |
常温下,某溶液中水电离出的c(OH-)>1×10-7mol?L-1,则该溶液不可能的构成是( )
| A、OH-、Br-、SO42-、K+ |
| B、F-、Na+、K+、NO3- |
| C、Na+、NH4+、CH3COO-、SO42- |
| D、K+、NO3-、NH4+、Cl- |
下列关于摩尔质量的叙述正确的是( )
| A、1molH2SO4的质量是98g/mol |
| B、CO2的摩尔质量等于CO2的相对分子质量 |
| C、1mol任何物质的质量等于该物质的相对分子质量 |
| D、Na的摩尔质量是23g/mol |
下列有关说法中,错误的是( )
| A、若NA表示阿伏加德罗常数的值,则标准状况下11.2 L H2所含氢原子数为NA |
| B、1 L 1 mol?L-1的氯化钙溶液中,Cl-的浓度为2 mol/L |
| C、硫酸的摩尔质量为98g |
| D、从 1 mol?L-1的NaCl溶液中倒出5 mL溶液,Na+的浓度为1 mol?L-1 |
下列反应的离子方程式书写不正确的是( )
| A、向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O |
| B、碳酸氢钠溶液与少量硫酸氢钠溶液反应:HCO3-+H+=CO2↑+H2O |
| C、少量稀硫酸溶液加入氢氧化钡溶液中:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| D、硫酸铝与足量氨水反应:Al3++3 NH3?H2O=Al(OH)3↓+3NH4+ |
下列事实能用勒夏特列原理解释的是( )
| A、H2、I2、HI平衡混合气体加压后颜色变深 |
| B、使用催化剂,提高合成氨的产率 |
| C、高锰酸钾(KMnO4)溶液加水稀释后颜色变浅 |
| D、新制的氯水在光照条件下颜色变浅 |