题目内容
下列叙述正确的是( )
| A、1.00molNaCl中含有6.02×1023个NaCl分子 |
| B、欲配置1.00L1.00mol/L的NaCl溶液,可将58.5gNaCl溶于1.00L水中 |
| C、1molNO2和N2O4混合气体中含有原子总数为3NA |
| D、1molNa与足量的O2反应,生成Na2O和Na2O2的混合物,共转移NA个电子 |
考点:物质的量的相关计算
专题:计算题
分析:A.NaCl属于离子晶体,不存在分子;
B.58.5gNaCl的物质的量为1mol,溶于水配成1L溶液,其浓度为1mol/L;
C.NO2和N2O4分子中含有原子总数不相等,二者物质的量不确定,不能确定含有原子总数;
D.根据Na元素化合价比较计算转移电子数目.
B.58.5gNaCl的物质的量为1mol,溶于水配成1L溶液,其浓度为1mol/L;
C.NO2和N2O4分子中含有原子总数不相等,二者物质的量不确定,不能确定含有原子总数;
D.根据Na元素化合价比较计算转移电子数目.
解答:
解:A.NaCl属于离子晶体,不存在分子,故A错误;
B.58.5gNaCl的物质的量为1mol,溶于水配成1L溶液,其浓度为1mol/L,体积1L是指溶液的体积,不是溶剂的体积,故B错误;
C.NO2和N2O4分子中含有原子总数不相等,二者物质的量不确定,不能确定含有原子总数,故C错误;
D.反应Na元素化合价都由0价升高为+1价,1molNa完全反应转移电子为1mol,即共转移NA个电子,故D正确,
故选D.
B.58.5gNaCl的物质的量为1mol,溶于水配成1L溶液,其浓度为1mol/L,体积1L是指溶液的体积,不是溶剂的体积,故B错误;
C.NO2和N2O4分子中含有原子总数不相等,二者物质的量不确定,不能确定含有原子总数,故C错误;
D.反应Na元素化合价都由0价升高为+1价,1molNa完全反应转移电子为1mol,即共转移NA个电子,故D正确,
故选D.
点评:本题考查物质的量有关计算,难度中等,A选项为易错点,学生容易忽略晶体类型.

练习册系列答案
相关题目
下列说法正确的是( )
| A、需要加热才能发生的反应一定是吸热反应 |
| B、若“M+N=X+Y”为放热反应,则1mol X和1mol Y的总能量一定大于1mol M和1mol N的总能量 |
| C、“H2(g)+Cl2(g)=2HCl(g);△H=-183kJ/mol”表示1分子H2和1分子Cl2反应,放出热量183kJ |
| D、化学反应必然引起化学键的变化,化学反应也必然伴随能量的变化 |
用3g块状大理石与30mL 3mol/L盐酸反应制取CO2气体,若要增大反应速率,可采取的措施是( )
①改用60mL 3mol/L盐酸 ②改用30mL 6mol/L盐酸 ③改用3g粉末状大理石 ④适当升高温度.
①改用60mL 3mol/L盐酸 ②改用30mL 6mol/L盐酸 ③改用3g粉末状大理石 ④适当升高温度.
| A、①②④ | B、②③④ |
| C、①③④ | D、①②③④ |
 乙醇分子结构中各种化学键如图所示,关于乙醇在各种反应中断裂键的说明不正确的是( )
乙醇分子结构中各种化学键如图所示,关于乙醇在各种反应中断裂键的说明不正确的是( )| A、和金属钠作用时,键①断裂 |
| B、和浓硫酸共热至170℃时,②键和⑤断裂 |
| C、在铜催化下和氧气反应时,键①和③断裂 |
| D、与氢卤酸反应时,①键断裂 |
甲醇燃料电池的电池反应为:2CH3OH+3O2
2CO32-+6H2O,则下列说法不正确的是( )
| 放电 |
| 充电 |
| A、充电时,电能转化为化学能 |
| B、充电时,电解质溶液中pH逐渐增大 |
| C、放电时,CH3OH参与反应的电极为负极,发生还原反应 |
| D、放电时,负极的电极反应为:CH3OH-6e-+8OH-═CO32-+6H2O |
如图所示,关于该装置的下列叙述中,不正确的是( )
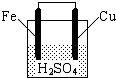

| A、铁棒是负极,发生氧化反应 |
| B、铜棒上有气体放出 |
| C、电流从锌片经导线流向铜片 |
| D、电池总反应方程式可表示为:Fe+2H+=Fe2++H2↑ |
常温下,某溶液中水电离出的c(OH-)>1×10-7mol?L-1,则该溶液不可能的构成是( )
| A、OH-、Br-、SO42-、K+ |
| B、F-、Na+、K+、NO3- |
| C、Na+、NH4+、CH3COO-、SO42- |
| D、K+、NO3-、NH4+、Cl- |
下列有关说法中,错误的是( )
| A、若NA表示阿伏加德罗常数的值,则标准状况下11.2 L H2所含氢原子数为NA |
| B、1 L 1 mol?L-1的氯化钙溶液中,Cl-的浓度为2 mol/L |
| C、硫酸的摩尔质量为98g |
| D、从 1 mol?L-1的NaCl溶液中倒出5 mL溶液,Na+的浓度为1 mol?L-1 |
人工合成化合物NH5 可改写成NH4H,能和水反应:NH5+H2O═NH3H2O+H2↑.下列说法正确的是( )
| A、NH5属于离子化合物,该反应中水做氧化剂 |
| B、该反应属于氧化还原反应,NH5既是氧化剂又是还原剂 |
| C、该反应不属于氧化还原反应,属于复分解反应 |
| D、标准状况下每生成22.4LH2时,转移2NA电子 |