题目内容
下列各实验装置图与操作正确且能达到实验目的( )
A、 实验室干燥氯气 |
B、 实验室收集SO2气体 |
C、 稀释浓硫酸 |
D、 鉴定Fe3+ |
考点:化学实验方案的评价
专题:实验评价题
分析:A.氯气能与氢氧化钠反应;
B.二氧化硫的密度比空气大;
C.容量瓶不能用来稀释溶液;
D.铁离子和硫氰根离子反应生成血红色硫氰化铁溶液.
B.二氧化硫的密度比空气大;
C.容量瓶不能用来稀释溶液;
D.铁离子和硫氰根离子反应生成血红色硫氰化铁溶液.
解答:
解:A.氯气能与氢氧化钠反应,应用浓硫酸干燥,故A错误;
B.二氧化硫的密度比空气大,应用向上排空气法收集,故B错误;
C.稀释浓硫酸时不能用容量瓶,应用烧杯,故C错误;
D.铁离子和硫氰根离子反应生成血红色硫氰化铁溶液,可以用硫氰化钾溶液检验铁离子,故D正确.
故选D.
B.二氧化硫的密度比空气大,应用向上排空气法收集,故B错误;
C.稀释浓硫酸时不能用容量瓶,应用烧杯,故C错误;
D.铁离子和硫氰根离子反应生成血红色硫氰化铁溶液,可以用硫氰化钾溶液检验铁离子,故D正确.
故选D.
点评:本题考查较为综合,涉及物质制备、气体收集、溶液稀释以及离子检验等知识,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意相关知识的学习与积累,难度不大.

练习册系列答案
相关题目
如图所示,关于该装置的下列叙述中,不正确的是( )
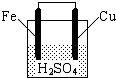

| A、铁棒是负极,发生氧化反应 |
| B、铜棒上有气体放出 |
| C、电流从锌片经导线流向铜片 |
| D、电池总反应方程式可表示为:Fe+2H+=Fe2++H2↑ |
下列反应的离子方程式书写不正确的是( )
| A、向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O |
| B、碳酸氢钠溶液与少量硫酸氢钠溶液反应:HCO3-+H+=CO2↑+H2O |
| C、少量稀硫酸溶液加入氢氧化钡溶液中:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| D、硫酸铝与足量氨水反应:Al3++3 NH3?H2O=Al(OH)3↓+3NH4+ |
下列有关说法正确的是( )
| A、放热反应在任何条件都能自发进行 |
| B、应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| C、任何能使熵值增大的过程都能自发进行 |
| D、△H>0,△S<0的化学反应一定能自发进行 |
人工合成化合物NH5 可改写成NH4H,能和水反应:NH5+H2O═NH3H2O+H2↑.下列说法正确的是( )
| A、NH5属于离子化合物,该反应中水做氧化剂 |
| B、该反应属于氧化还原反应,NH5既是氧化剂又是还原剂 |
| C、该反应不属于氧化还原反应,属于复分解反应 |
| D、标准状况下每生成22.4LH2时,转移2NA电子 |
关于如图所示各装置的叙述中,正确的是( )
A、 是原电池,总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
B、 通电一段时间后石墨Ⅱ电极附近溶液红褐色加深 |
C、若用 精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |
D、 研究的是金属的析氢腐蚀,Fe上的反应为Fe-2e-=Fe2+ |
下列事实能用勒夏特列原理解释的是( )
| A、H2、I2、HI平衡混合气体加压后颜色变深 |
| B、使用催化剂,提高合成氨的产率 |
| C、高锰酸钾(KMnO4)溶液加水稀释后颜色变浅 |
| D、新制的氯水在光照条件下颜色变浅 |
有机物分子中的原子(团)之间会相互影响,导致相同的原子(团)表现不同的性质.下列各项的事实不能说明上述观点的是( )
| A、甲苯能使酸性高锰酸钾溶液褪色,而甲基环己烷不能使酸性高锰酸钾褪色 |
| B、乙烯能与溴水发生加成反应,而乙烷不能发生加成反应 |
| C、苯酚与溴水可直接反应,而苯与液溴反应则需要铁作催化剂 |
| D、苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应 |