题目内容
已知25℃时有关弱酸的电离平衡常数:则下列有关说法不正确的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 | HClO |
| 电离常数K(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 | 2.95×10-8 |
| A、amol/L的氯水溶液中,C(H+)<C(Cl-)+C(HClO)+C(OH-) |
| B、等物质的量浓度的各溶液pH关系为:PH(NaCN)>PH(NaClO)>PH(Na2CO3)>PH(CH3COONa) |
| C、0.1mol/L醋酸中逐滴加水,则醋酸的电离程度增大,C(H+)、C(CH3COO-)减小,C(OH-)增大 |
| D、NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)>c(OH-)+c(HCO3-)+c(CO32-) |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A、氯水中存在电荷守恒,HClO只有小部分部分电离;
B、利用酸的电离常数比较酸性的强弱,再利用盐中酸根离子对应的酸越弱,其水解程度越大来分析;
C、冰醋酸中逐滴加水电离程度一直在增大,pH也是增大且无限接近中性溶液的pH.
D、利用电荷守恒来分析.
B、利用酸的电离常数比较酸性的强弱,再利用盐中酸根离子对应的酸越弱,其水解程度越大来分析;
C、冰醋酸中逐滴加水电离程度一直在增大,pH也是增大且无限接近中性溶液的pH.
D、利用电荷守恒来分析.
解答:
解:A、amol/L的氯水溶液中,存在电荷守恒,C(H+)=C(Cl-)+C(ClO-)+C(OH-),HClO是弱电解质只有小部分电离,则C(HClO)>C(ClO-),所以C(H+)<C(Cl-)+C(HClO)+C(OH-),故A正确.
B、由电离常数Ka的关系可知,1.8×10-5>2.95×10-8>4.9×10-10>5.6×10-11,则酸性CH3COOH>HClO>HCN>HCO3-,显然等浓度时Na2CO3的水解程度最大,其溶液的pH最大,则等物质的量浓度的各溶液pH关系为pH(Na2CO3)>pH(NaCN)>PH(NaClO)>pH(CH3COONa),故B错误;
C、冰醋酸中逐滴加水,电离产生的离子浓度增大,但随水的量增大,浓度变小,C(H+)、C(CH3COO-)减小,Kw不变,则C(OH-)增大,故C正确;
D、因溶液不显电性,则所有阳离子带的电荷总数等于阴离子带的负电荷总数,即c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),则c(Na+)+c(H+)>c(OH-)+c(HCO3-)+c(CO32-),故D正确;
故选B.
B、由电离常数Ka的关系可知,1.8×10-5>2.95×10-8>4.9×10-10>5.6×10-11,则酸性CH3COOH>HClO>HCN>HCO3-,显然等浓度时Na2CO3的水解程度最大,其溶液的pH最大,则等物质的量浓度的各溶液pH关系为pH(Na2CO3)>pH(NaCN)>PH(NaClO)>pH(CH3COONa),故B错误;
C、冰醋酸中逐滴加水,电离产生的离子浓度增大,但随水的量增大,浓度变小,C(H+)、C(CH3COO-)减小,Kw不变,则C(OH-)增大,故C正确;
D、因溶液不显电性,则所有阳离子带的电荷总数等于阴离子带的负电荷总数,即c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),则c(Na+)+c(H+)>c(OH-)+c(HCO3-)+c(CO32-),故D正确;
故选B.
点评:本题考查酸碱混合的定性判断,离子浓度大小比较,盐类水解的应用,以及弱电解质的电离等知识,题目难度较大,注意酸性强弱的比较以及溶液守恒方法的应用.

练习册系列答案
相关题目
下列变化需加入还原剂才能实现的是( )
| A、HCl→Cl2 | ||
| B、Fe→Fe3+ | ||
| C、KClO3→O2 | ||
D、MnO
|
如图所示,关于该装置的下列叙述中,不正确的是( )
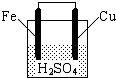

| A、铁棒是负极,发生氧化反应 |
| B、铜棒上有气体放出 |
| C、电流从锌片经导线流向铜片 |
| D、电池总反应方程式可表示为:Fe+2H+=Fe2++H2↑ |
下列关于摩尔质量的叙述正确的是( )
| A、1molH2SO4的质量是98g/mol |
| B、CO2的摩尔质量等于CO2的相对分子质量 |
| C、1mol任何物质的质量等于该物质的相对分子质量 |
| D、Na的摩尔质量是23g/mol |
下列有关说法中,错误的是( )
| A、若NA表示阿伏加德罗常数的值,则标准状况下11.2 L H2所含氢原子数为NA |
| B、1 L 1 mol?L-1的氯化钙溶液中,Cl-的浓度为2 mol/L |
| C、硫酸的摩尔质量为98g |
| D、从 1 mol?L-1的NaCl溶液中倒出5 mL溶液,Na+的浓度为1 mol?L-1 |
下列可逆反应一定处于平衡状态的是( )
| A、2HBr(g)?Br2 (g)+H2 (g),固定反应容器中压强不再改变. |
| B、N2(g)+3H2 (g)?2 NH3 (g) 测得正反应速率υ(N2)=0.01 mol?L-1?min-1,逆反应速率υ,(NH3 )=0.01 mol?L-1?mⅠn-1 |
| C、2SO2 (g)+O2 (g)?2SO3(g),在 t1和t2 时刻SO2 的转化率为 40% |
| D、2CO(g)+O2(g)?2CO2(g),测得混合物中CO、O2和CO2的物质的量之比为 2:1:1 |
下列反应的离子方程式书写不正确的是( )
| A、向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O |
| B、碳酸氢钠溶液与少量硫酸氢钠溶液反应:HCO3-+H+=CO2↑+H2O |
| C、少量稀硫酸溶液加入氢氧化钡溶液中:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| D、硫酸铝与足量氨水反应:Al3++3 NH3?H2O=Al(OH)3↓+3NH4+ |
下列有关说法正确的是( )
| A、放热反应在任何条件都能自发进行 |
| B、应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| C、任何能使熵值增大的过程都能自发进行 |
| D、△H>0,△S<0的化学反应一定能自发进行 |
有机物分子中的原子(团)之间会相互影响,导致相同的原子(团)表现不同的性质.下列各项的事实不能说明上述观点的是( )
| A、甲苯能使酸性高锰酸钾溶液褪色,而甲基环己烷不能使酸性高锰酸钾褪色 |
| B、乙烯能与溴水发生加成反应,而乙烷不能发生加成反应 |
| C、苯酚与溴水可直接反应,而苯与液溴反应则需要铁作催化剂 |
| D、苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应 |