题目内容
2.下列关于${\;}_{2}^{3}$He的说法中正确的是( )| A. | ${\;}_{2}^{3}$He原子核内有2个中子 | |
| B. | ${\;}_{2}^{3}$He原子核外有3个电子 | |
| C. | ${\;}_{2}^{3}$He原子核内有3个质子 | |
| D. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He是两种不同的核素 |
分析 原子符号左上角的数字为质量数,左下角的数字为质子数,原子中,质量数=质子数+中子数,质子数=核外电子数,据此解题.
解答 解:A.32He原子核内含有2个质子,中子数为3-2=1,故A错误;
B.32He原子核内含有2个质子,原子核外有2个电子,故B错误;
C.32He原子核内含有2个质子,故C错误;
D.32He和42He的质子数均为2,中子数不同,是两种不同的核素,故D正确.
故选D.
点评 本题考查核素,把握原子表示方法中不同位置数字的意义及原子中的数量关系为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
12.下列各组物质在反应时生成白色烟的是( )
| A. | 氢气在氯气中燃烧 | B. | 钠在氯气中燃烧 | ||
| C. | 氢气在氧气中燃烧 | D. | 细铁丝在氯气中燃烧 |
17.下列离子方程式中,正确的是( )
| A. | 铁与氯化铁溶液反应:Fe+Fe3+═2Fe2+ | |
| B. | 氢氧化钡溶液与硫酸反应:OHˉ+SO42-+Ba2++H+═H2O+BaSO4 | |
| C. | 二氧化硅与氢氧化钠溶液反应:SiO2+OHˉ═H2SiO3 | |
| D. | 碳酸钙与盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
14.几种短周期元素的原子半径及主要化合价如下表:
下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | -3、+5 | -2 |
| A. | X、Y元素的金属性:X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,W单质可以和Z的氢化物反应 |
11.下列说法正确的是( )
| A. | Na+、Fe2+、Cl-、NO3-等离子能在甲基橙试液显红色的溶液中共存 | |
| B. | K+、Mg2+、Cl-、I-等离子能在[H+]=10-12 mol•L-1的溶液中共存 | |
| C. | NaHS水解的离子方程式为:HS-+H2O?S2-+H3O+ | |
| D. | NaHCO3的电离方程式为:NaHCO3=Na++HCO3-,HCO3-?H++CO32- |
4.在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
下列说法正确的是( )
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为60% | |
| B. | 在25℃时,反应可表示为X+3Y═2Z,其平衡常数为1600 | |
| C. | 增大压强使平衡向生成Z的方向移动,平衡常数增大 | |
| D. | 升高温度此反应的平衡常数增大 |

 ;
;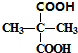 +2C2H5OH$?_{△}^{浓硫酸}$
+2C2H5OH$?_{△}^{浓硫酸}$ +2H2O.
+2H2O. 、
、 .
.