题目内容
14.几种短周期元素的原子半径及主要化合价如下表:| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | -3、+5 | -2 |
| A. | X、Y元素的金属性:X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,W单质可以和Z的氢化物反应 |
分析 W的化合价只有-2价,故W为氧元素;Z具有-3、+5价,原子半径大于氧元素且相差不大,故Z为氮元素;X只有+2价,Y只有+3价,X、Y原子半径相差不大,原子半径较氮元素、氧元素大很多,可知X、Y位于第三周期相邻主族,故X为镁元素,Y为铝元素,结合元素周期律与元素单质化合物性质解答.
解答 解:W的化合价只有-2价,故W为氧元素;Z具有-3、+5价,原子半径大于氧元素且相差不大,故Z为氮元素;X只有+2价,Y只有+3价,X、Y原子半径相差不大,原子半径较氮元素、氧元素大很多,可知X、Y位于第三周期相邻主族,故X为镁元素,Y为铝元素.
A.X为镁元素,Y为铝元素,同周期自左而右,金属性减弱,故金属性X>Y,故A错误;
B.W为氧元素、Z为氮元素,两者的单质一定条件下直接生成NO,故B错误;
C.Y是Al,Al的最高价氧化物的水化物是氢氧化铝,氢氧化铝是两性氢氧化物,溶于强酸强碱,不溶于弱酸弱碱,氢氧化铝不溶于氨水,故C错误;
D.一定条件下,氧气可以和氨气反应生成水和NO,故D正确.
故选D.
点评 本题考查结构性质位置关系应用,难度中等,利用原子半径及化合价推断元素是解答本题的关键,并熟悉元素及其单质、化合物的性质来解答即可.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列反应的离子方程式书写中,正确的是( )
| A. | 硫酸与氢氧化钡在溶液中反应Ba2++SO42-═BaSO4↓ | |
| B. | 氢氧化镁溶于稀硫酸:2H++Mg(OH)2═Mg2++2H2O | |
| C. | 大理石与盐酸反应 CO32-+2H+═H2O+CO2↑ | |
| D. | 少量金属钠投入到CuSO4溶液中 2Na+Cu2+═2Na++Cu |
2.下列关于${\;}_{2}^{3}$He的说法中正确的是( )
| A. | ${\;}_{2}^{3}$He原子核内有2个中子 | |
| B. | ${\;}_{2}^{3}$He原子核外有3个电子 | |
| C. | ${\;}_{2}^{3}$He原子核内有3个质子 | |
| D. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He是两种不同的核素 |
9.分类法是化学研究的重要方法,对下列物质的分类,正确的是( )
| A. | 同分异构体: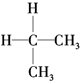 、 、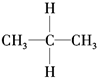 | B. | 烷烃:CH4、 、CH2═CH2 、CH2═CH2 | ||
| C. | 糖类:葡萄糖、蔗糖、纤维素 | D. | 有机高分子:塑料、橡胶、油脂 |
19.水溶液中能大量共存的一组离子是( )
| A. | Fe2+、H+、SO32-、ClO- | B. | Na+、Cu2+、Cl-、SO42- | ||
| C. | Pb2+、NH4+、Cl-、CH3CHOO- | D. | K+、Fe3+、NO3-、SCN- |
6.在无色强酸性溶液中,下列各组离子能够大量共存的是( )
| A. | K+、Ca2+、Cl-、SO42- | B. | NH4+、HCO3-、Cl-、K+ | ||
| C. | Cl-、Na+、NO3-、Ca2+ | D. | MnO4-、NO3-、Na+、Cl- |
3.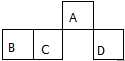 短周期元素A、B、C、D在元素周期表中的相对位置如图.其中A原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
短周期元素A、B、C、D在元素周期表中的相对位置如图.其中A原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
 短周期元素A、B、C、D在元素周期表中的相对位置如图.其中A原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
短周期元素A、B、C、D在元素周期表中的相对位置如图.其中A原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )| A. | 原子半径:rD>rC>rB>rA | |
| B. | 含D元素的盐溶液一定显中性 | |
| C. | 氢化物的热稳定性:C>D | |
| D. | D的单质能与A形成的氢化物反应生成具有漂白性的物质 |