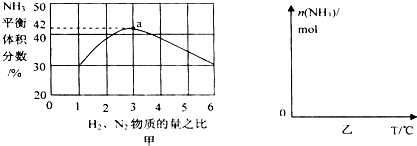
题目内容
11.下列说法正确的是( )| A. | Na+、Fe2+、Cl-、NO3-等离子能在甲基橙试液显红色的溶液中共存 | |
| B. | K+、Mg2+、Cl-、I-等离子能在[H+]=10-12 mol•L-1的溶液中共存 | |
| C. | NaHS水解的离子方程式为:HS-+H2O?S2-+H3O+ | |
| D. | NaHCO3的电离方程式为:NaHCO3=Na++HCO3-,HCO3-?H++CO32- |
分析 A.甲基橙试液显红色的溶液中存在大量氢离子,硝酸根离子在酸性条件下能够氧化亚铁离子;
B.[H+]=10-12 mol•L-1的溶液中存在大量氢氧根离子,镁离子与氢氧根离子反应生成氢氧化镁沉淀;
C.HS-+H2O?S2-+H3O+为电离方程式,不是水解方程式;
D.碳酸氢钠为强电解质,在溶液中电离出钠离子和碳酸氢根离子,碳酸氢根离子部分电离出氢离子和碳酸根离子.
解答 解:A.甲基橙试液显红色的溶液为酸性溶液,Fe2+、NO3-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故A错误;
B.[H+]=10-12 mol•L-1的溶液为碱性溶液,溶液中存在大量氢氧根离子,Mg2+与氢氧根离子反应生成难溶物氢氧化镁,在溶液中不能大量共存,故B错误;
C.硫氢根离子水解生成硫化氢和氢氧根离子,正确的水解方程式为:HS-+H2O?H2S+OH-,故C错误;
D.碳酸氢钠的电离用等号,电离方程式为:NaHCO3=Na++HCO3-,碳酸氢根离子的电离用可逆号,电离方程式为:HCO3-?H++CO32-,故D正确;
故选D.
点评 本题考查离子共存的判断,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”等.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
1.硫代硫酸钠是重要的还原剂,可用作含氮尾气处理剂、媒染剂、漂白剂等,利用重晶石生产中的副产品液态硫化钠(Na2S,含少量Na2SO3、Na2CO3及不溶性杂质)生产硫代硫酸钠的工艺流程如下:
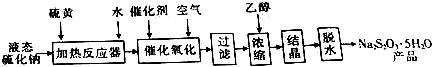
回答下列问题:
(1)反应器中Na2S与S按物质的量之比1:1反应的离子方程式为S2-+S=2S2-,反应器需加热的目的是使Na2S与S能充分反应
(2)氧化时,加入催化剂[m(MnSO4):m(NiSO4•7H2O)=1:4],测得不同温度下完全氧化所需时间如表:
氧化时适宜的操作温度为20℃~30℃,在50℃时,氧化完全所需时间比40℃时长得多,其原因是NiSO4•7H2O失去结晶水,而使催化剂的催化作用减弱
(3)过滤时,滤渣的主要成分为硫及液态硫化钠原料中的杂质,浓缩时加入适量乙醇的目的是减小Na2S2O3的溶解度.

回答下列问题:
(1)反应器中Na2S与S按物质的量之比1:1反应的离子方程式为S2-+S=2S2-,反应器需加热的目的是使Na2S与S能充分反应
(2)氧化时,加入催化剂[m(MnSO4):m(NiSO4•7H2O)=1:4],测得不同温度下完全氧化所需时间如表:
| 溶液温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 氧化完全所需时间/h | 6 | 5.5 | 5.5 | 6 | 20 | 16 | 11 | 11 |
(3)过滤时,滤渣的主要成分为硫及液态硫化钠原料中的杂质,浓缩时加入适量乙醇的目的是减小Na2S2O3的溶解度.
2.下列关于${\;}_{2}^{3}$He的说法中正确的是( )
| A. | ${\;}_{2}^{3}$He原子核内有2个中子 | |
| B. | ${\;}_{2}^{3}$He原子核外有3个电子 | |
| C. | ${\;}_{2}^{3}$He原子核内有3个质子 | |
| D. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He是两种不同的核素 |
19.水溶液中能大量共存的一组离子是( )
| A. | Fe2+、H+、SO32-、ClO- | B. | Na+、Cu2+、Cl-、SO42- | ||
| C. | Pb2+、NH4+、Cl-、CH3CHOO- | D. | K+、Fe3+、NO3-、SCN- |
6.在无色强酸性溶液中,下列各组离子能够大量共存的是( )
| A. | K+、Ca2+、Cl-、SO42- | B. | NH4+、HCO3-、Cl-、K+ | ||
| C. | Cl-、Na+、NO3-、Ca2+ | D. | MnO4-、NO3-、Na+、Cl- |
3.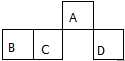 短周期元素A、B、C、D在元素周期表中的相对位置如图.其中A原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
短周期元素A、B、C、D在元素周期表中的相对位置如图.其中A原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
 短周期元素A、B、C、D在元素周期表中的相对位置如图.其中A原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
短周期元素A、B、C、D在元素周期表中的相对位置如图.其中A原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )| A. | 原子半径:rD>rC>rB>rA | |
| B. | 含D元素的盐溶液一定显中性 | |
| C. | 氢化物的热稳定性:C>D | |
| D. | D的单质能与A形成的氢化物反应生成具有漂白性的物质 |
12. 某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).
某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).
(1)用A、B、O表示这类特殊晶体的化学式ABO3.在图中,与A原子配位的氧原子数目为12.
(2)基态Cr原子的核外电子排布式为1s22s22p63s23p63d54s1,其中电子的运动状态有24种.
(3)某些钙钛型复合氧化物能够催化NO直接分解为N2和O2,N和O的基态原子中,未成对的电子数目比为3:2.
(4)下表是几种碳酸盐的热分解温度和阳离子半径
请解释碳酸钙热分解温度最低的原因:碳酸盐的热分解是由于晶体中的阳离子结合碳酸根中的氧离子,使碳酸根分解为二氧化碳分子的结果.钙离子由于半径小和氧离子结合更为容易,氧化钙晶格能大,所以碳酸钙分解温度低.
 某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).
某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).(1)用A、B、O表示这类特殊晶体的化学式ABO3.在图中,与A原子配位的氧原子数目为12.
(2)基态Cr原子的核外电子排布式为1s22s22p63s23p63d54s1,其中电子的运动状态有24种.
(3)某些钙钛型复合氧化物能够催化NO直接分解为N2和O2,N和O的基态原子中,未成对的电子数目比为3:2.
(4)下表是几种碳酸盐的热分解温度和阳离子半径
| 碳酸盐 | CaCO3 | SrCO3 | BaCO3 |
| 热分解温度/℃ | 900 | 1172 | 1360 |
| 阳离子半径/pm | 99 | 112 | 135 |
13.下列溶液中各微粒的浓度关系不正确的是( )
| A. | 0.1 mol•L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) | |
| B. | 1L0.1mol•L-1 CuSO4•(NH4)2SO4•6H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-) | |
| C. | 常温下,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时:c(NH4+)=2c(SO42-) | |
| D. | 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |

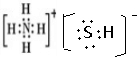 ,写出再生反应的化学方程式:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S;NH3的沸点高于H2S,是因为NH3分子之间存在着一种叫氢键的作用力.
,写出再生反应的化学方程式:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S;NH3的沸点高于H2S,是因为NH3分子之间存在着一种叫氢键的作用力.