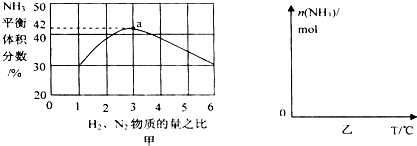
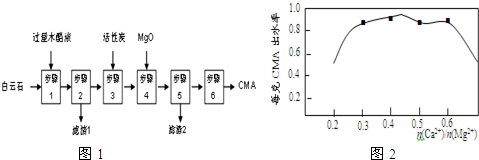
题目内容
7.16g某一元醇与足量的金属钠完全反应,在标准状态下得到5.6L氢气.求该一元醇的分子式.(要有解题过程)分析 金属与醇反应,醇中-OH中的氢原子被还原生成氢气,根据H原子守恒可知,n(一元醇)=2n(H2),根据n=$\frac{V}{{V}_{m}}$计算氢气的物质的量,再根据M=$\frac{m}{n}$计算一元醇的摩尔质量,进而确定醇的分子式.
解答 解:标准状况下得到5.6L 氢气的物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,所以n(一元醇)=2n(H2)=2×0.25mol=0.5mol,故该一元醇的摩尔质量为$\frac{16g}{0.5mol}$=32g/mol,去掉1个-OH剩余原子相对原子质量之和为32-17=15,只能为-CH3,则该有机物分子式为CH3OH,
答:该有机物分子式为CH3OH.
点评 本题考查有机物分子式的确定,比较基础,判断氢气与一元醇的物质的量关系是关键.

练习册系列答案
相关题目
17.2012年2月,国务院同意发布新修订的《环境空气质量标准》增加了PM 2.5监测指标(PM 2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物).下列情况不会增加空气中PM 2.5的是( )
| A. | 直接露天焚烧秸秆 | B. | ?风能发电 | ||
| C. | 汽车直接排放尾气 | D. | 用石油作燃料 |
18.已知水的电离方程式:H2O?H++OH-.下列叙述中,正确的是( )
| A. | 升高温度,KW增大,pH不变 | |
| B. | 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低 | |
| C. | 向水中加入少量氯化铵,c(H+)增大 | |
| D. | 向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低 |
15.下列变化,不能通过一步反应实现的是( )
| A. | Cl2→HCl | B. | NO2→HNO3 | C. | Fe2O3→Fe | D. | SiO2→H2SiO3 |
2.下列关于${\;}_{2}^{3}$He的说法中正确的是( )
| A. | ${\;}_{2}^{3}$He原子核内有2个中子 | |
| B. | ${\;}_{2}^{3}$He原子核外有3个电子 | |
| C. | ${\;}_{2}^{3}$He原子核内有3个质子 | |
| D. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He是两种不同的核素 |
12.下表是元素周期表的一部分,请用化学用语回答:
(1)最高价氧化物对应的水化物中酸性最强的是HClO4;
(2)实验室制取②的氢化物的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(3)④和⑤元素最高价氧化物对应的水化物相互反应的化学方程式NaOH+Al(OH)3=NaAlO2+2H2O;
(4)元素②、⑥与氢元素形成的一种化合物含有的化学键类型有离子键、共价键;其电子式为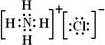 .
.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ | ⑨ |
(2)实验室制取②的氢化物的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(3)④和⑤元素最高价氧化物对应的水化物相互反应的化学方程式NaOH+Al(OH)3=NaAlO2+2H2O;
(4)元素②、⑥与氢元素形成的一种化合物含有的化学键类型有离子键、共价键;其电子式为
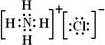 .
.
19.水溶液中能大量共存的一组离子是( )
| A. | Fe2+、H+、SO32-、ClO- | B. | Na+、Cu2+、Cl-、SO42- | ||
| C. | Pb2+、NH4+、Cl-、CH3CHOO- | D. | K+、Fe3+、NO3-、SCN- |

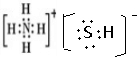 ,写出再生反应的化学方程式:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S;NH3的沸点高于H2S,是因为NH3分子之间存在着一种叫氢键的作用力.
,写出再生反应的化学方程式:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S;NH3的沸点高于H2S,是因为NH3分子之间存在着一种叫氢键的作用力.