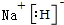题目内容
17.下列离子方程式中,正确的是( )| A. | 铁与氯化铁溶液反应:Fe+Fe3+═2Fe2+ | |
| B. | 氢氧化钡溶液与硫酸反应:OHˉ+SO42-+Ba2++H+═H2O+BaSO4 | |
| C. | 二氧化硅与氢氧化钠溶液反应:SiO2+OHˉ═H2SiO3 | |
| D. | 碳酸钙与盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
分析 A.电子、电荷不守恒;
B.不符合离子的配比;
C.反应生成硅酸钠和水;
D.反应生成氯化钙、水、二氧化碳.
解答 解:A.铁与氯化铁溶液反应的离子反应为Fe+2Fe3+═3Fe2+,故A错误;
B.氢氧化钡溶液与硫酸反应的离子反应为2OH-+SO42-+Ba2++2H+═2H2O+BaSO4↓,故B错误;
C.二氧化硅与氢氧化钠溶液反应的离子反应为SiO2+2OH-═SiO32-+H2O,故C错误;
D.碳酸钙与盐酸反应的离子反应为CaCO3+2H+═Ca2++CO2↑+H2O,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应及分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
7.下列叙述中不正确的是( )
| A. | 一定浓度的醋酸钠溶液可使酚酞溶液变红,其原因是发生了如下反应:CH3COO-+H2O?CH3COOH+OH-,使得溶液中的c(OH-)>c(H+) | |
| B. | 在常温下,10 mL 0.2 mol•L-1盐酸与10 mL 0.2 mol•L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=13 | |
| C. | 在0.1 mol•L-1 NH4Cl溶液中:c(H+)+c(NH4+=c(Cl-) | |
| D. | 5 mL 1 mol•L-1 CH3COONa溶液与5 mL 1 mol•L-1盐酸混合液中c(Cl-)=c(Na+)>c(H+)>c(OH-) |
8.实验是化学研究的基础,下列是在实验室中完成的不同的化学实验,其中能达到实验目的是( )
| A. |  石油的分馏 | B. |  分离硝基苯和水 | ||
| C. |  除去甲烷中的乙烯 | D. |  制取并收集乙炔气体 |
5.下列反应的离子方程式书写中,正确的是( )
| A. | 硫酸与氢氧化钡在溶液中反应Ba2++SO42-═BaSO4↓ | |
| B. | 氢氧化镁溶于稀硫酸:2H++Mg(OH)2═Mg2++2H2O | |
| C. | 大理石与盐酸反应 CO32-+2H+═H2O+CO2↑ | |
| D. | 少量金属钠投入到CuSO4溶液中 2Na+Cu2+═2Na++Cu |
12. 如下表是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题
如下表是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,①元素位于周期表的s区.
(2)②、⑥两元素形成的化合物的空间构型为平面正三角形,其中心原子的杂化类型为sp2.
(3)写出元素⑧基态原子的电子排布式1s22s22p63s23p63d104s1.
(4)比较:第一电离能:③<④,电负性:④<⑤(填“>”或“<”或“=”).
(5)元素⑦与CO可形成的X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于分子晶体(填晶体类型).
(6)元素⑨的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为配位键.
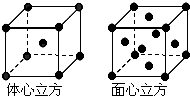
(7)金属⑦的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为2:1.
 如下表是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题
如下表是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题 | ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||
| ⑦ | ⑧ | ⑨ | |||||||||||||||
(2)②、⑥两元素形成的化合物的空间构型为平面正三角形,其中心原子的杂化类型为sp2.
(3)写出元素⑧基态原子的电子排布式1s22s22p63s23p63d104s1.
(4)比较:第一电离能:③<④,电负性:④<⑤(填“>”或“<”或“=”).
(5)元素⑦与CO可形成的X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于分子晶体(填晶体类型).
(6)元素⑨的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为配位键.
(7)金属⑦的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为2:1.
2.下列关于${\;}_{2}^{3}$He的说法中正确的是( )
| A. | ${\;}_{2}^{3}$He原子核内有2个中子 | |
| B. | ${\;}_{2}^{3}$He原子核外有3个电子 | |
| C. | ${\;}_{2}^{3}$He原子核内有3个质子 | |
| D. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He是两种不同的核素 |
9.分类法是化学研究的重要方法,对下列物质的分类,正确的是( )
| A. | 同分异构体: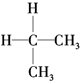 、 、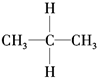 | B. | 烷烃:CH4、 、CH2═CH2 、CH2═CH2 | ||
| C. | 糖类:葡萄糖、蔗糖、纤维素 | D. | 有机高分子:塑料、橡胶、油脂 |
6.在无色强酸性溶液中,下列各组离子能够大量共存的是( )
| A. | K+、Ca2+、Cl-、SO42- | B. | NH4+、HCO3-、Cl-、K+ | ||
| C. | Cl-、Na+、NO3-、Ca2+ | D. | MnO4-、NO3-、Na+、Cl- |
 已知X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y2是空气主要成分之一.请回答:
已知X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y2是空气主要成分之一.请回答: