题目内容
对于铜--锌原电池(如图),以下说法不正确的是( )
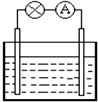

| A、铜为正极 |
| B、锌片上发生氧化反应 |
| C、它是一种把化学能转变为电能的装置 |
| D、电子从铜片流出沿导线流入锌片 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:锌、铜和稀硫酸组成的原电池中,锌作负极,负极上锌失电子发生氧化反应;铜作正极,正极上氢离子得电子发生还原反应;电子从负极沿导线流向正极,据此分析.
解答:
解:A、锌、铜和稀硫酸组成的原电池中,活泼性弱的金属铜作正极,故A正确;
B、锌、铜和稀硫酸组成的原电池中,锌作负极,负极上锌失电子发生氧化反应,故B正确;
C、该装置为原电池,是一种把化学能转化为电能的装置,故C正确;
D、锌作负极失电子,所以电子从Zn流向Cu,故D错误;
故选D.
B、锌、铜和稀硫酸组成的原电池中,锌作负极,负极上锌失电子发生氧化反应,故B正确;
C、该装置为原电池,是一种把化学能转化为电能的装置,故C正确;
D、锌作负极失电子,所以电子从Zn流向Cu,故D错误;
故选D.
点评:本题考查了原电池原理,难度不大,易错选项是D,注意电子的移动方向从负极到正极.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
向饱和Na2CO3溶液中通入足量CO2,下列说法不正确的是( )
| A、溶液中有Na2CO3?10H2O晶体析出 |
| B、溶液中的PH减小 |
| C、溶液中发生的离子反应为:CO2+H2O+CO32-═2HCO3- |
| D、溶液中Na+的物质的量减少 |
已知20℃下,AgCl和AgBr的溶解度分别为1.5×10-4g、8.4×10-6g.分别取AgCl和AgBr饱和溶液的上层清夜,按体积比1:1充分混合,再加入足量浓AgNO3溶液,则( )
| A、加浓AgNO3前,混合溶液中肯定没有沉淀析出 |
| B、加浓AgNO3前,混合溶液中AgCl、AgBr均已达到饱和 |
| C、加浓AgNO3后,得到两种沉淀,以AgBr沉淀为主 |
| D、加浓AgNO3后,得到两种沉淀,以AgCl沉淀为主 |
将过氧化钠和过量的碳酸氢钠在密闭容器中混合充分加热后,最终残留固体物质是( )
| A、Na2CO3 |
| B、Na2O和Na2O2 |
| C、Na2O2 |
| D、Na2O2和Na2CO3 |
有A、B、C、D四种非金属元素:A、B在反应中各结合1个电子,形成稳定的结构,且B-的还原性小于A-的还原性;氢化物稳定性HD<HA;原子序数C<D,且C、D的稳定结构的核外电子数相等.则这四种元素非金属金属由强到弱的排列顺序是( )
| A、A、B、C、D |
| B、B、A、C、D |
| C、A、B、D、C |
| D、B、A、D、C |
 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入Fe粉,溶液中Fe2+浓度和加入Fe粉的物质的量之间的关系如如图所示.则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入Fe粉,溶液中Fe2+浓度和加入Fe粉的物质的量之间的关系如如图所示.则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )| A、1:1:1 |
| B、1:1:4 |
| C、1:2:2 |
| D、3:2:8 |


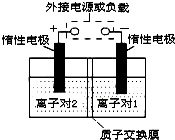 全钒液流储能电池,是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置.现将钒的相关化合物溶解在pH=1的稀硫酸中,按下图组装一个模拟电池.
全钒液流储能电池,是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置.现将钒的相关化合物溶解在pH=1的稀硫酸中,按下图组装一个模拟电池.