题目内容
向饱和Na2CO3溶液中通入足量CO2,下列说法不正确的是( )
| A、溶液中有Na2CO3?10H2O晶体析出 |
| B、溶液中的PH减小 |
| C、溶液中发生的离子反应为:CO2+H2O+CO32-═2HCO3- |
| D、溶液中Na+的物质的量减少 |
考点:钠的重要化合物
专题:
分析:向饱和Na2CO3溶液中通入足量CO2,发生反应Na2CO3+CO2+H2O=2NaHCO3,Na2CO3溶解度大于NaHCO3,则NaHCO3溶液为过饱和溶液,所以生成NaHCO3沉淀导致溶液变浑浊,据此分析解答.
解答:
解:向饱和Na2CO3溶液中通入足量CO2,发生反应Na2CO3+CO2+H2O=2NaHCO3,Na2CO3溶解度大于NaHCO3,则NaHCO3溶液为过饱和溶液,所以生成NaHCO3沉淀导致溶液变浑浊,
A.溶液中有NaHCO3沉淀生成而不是Na2CO3?10H2O晶体析出,故A错误;
B.溶液中的溶质由NaHCO3转化为NaHCO3,碳酸根离子水解程度大于碳酸氢根离子,则溶液的碱性减弱,pH减小,故B正确;
C.通过以上分析知,溶液中发生的离子反应为:2Na++CO2+H2O+CO32-═2NaHCO3↓,故C错误;
D.因为有NaHCO3沉淀生成,导致溶液中Na+的物质的量减少,故D正确;
故选AC.
A.溶液中有NaHCO3沉淀生成而不是Na2CO3?10H2O晶体析出,故A错误;
B.溶液中的溶质由NaHCO3转化为NaHCO3,碳酸根离子水解程度大于碳酸氢根离子,则溶液的碱性减弱,pH减小,故B正确;
C.通过以上分析知,溶液中发生的离子反应为:2Na++CO2+H2O+CO32-═2NaHCO3↓,故C错误;
D.因为有NaHCO3沉淀生成,导致溶液中Na+的物质的量减少,故D正确;
故选AC.
点评:本题考查碳酸氢钠、碳酸钠,明确二者水解程度大小、溶解性即可解答,注意原来溶液为饱和溶液,题目难度不大.

练习册系列答案
相关题目
下列试剂的保存方法正确的是( )
| A、氢氟酸存放在玻璃瓶中 |
| B、烧碱溶液存放在带橡皮塞的玻璃瓶中 |
| C、水玻璃存放在滴瓶中 |
| D、金属钠保存在冷水里 |
下列物质属于同分异构体的一组是( )
| A、CH4与C2H4 |
B、 与 CH3-CH2-CH2-CH3 与 CH3-CH2-CH2-CH3 |
| C、C2H6与C3H8 |
| D、O2与O3 |
有些单质,易溶于含同一元素的盐溶液中,如:硫易溶于硫化钾溶液中,对于由①CaCO3、②KI、③Al(OH)3、④AgOH(Ag2O)、⑤I2五种物质所组成的混合物,要使其每种成分逐一溶解(一次只溶解一种物质),试剂选用顺序正确的是( )
| A、氨水 乙醇 水 氢氧化钾 硝酸 |
| B、四氯化碳 水 氨水 氢氧化钠 盐酸 |
| C、水 苯 氨水 氢氧化钾 硝酸 |
| D、水 盐酸 氢氧化钠 氨水 乙醇 |
对于铜--锌原电池(如图),以下说法不正确的是( )
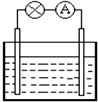

| A、铜为正极 |
| B、锌片上发生氧化反应 |
| C、它是一种把化学能转变为电能的装置 |
| D、电子从铜片流出沿导线流入锌片 |

