题目内容
将氧化还原反应 Zn+Cu2+=Cu+Zn2+设计成原电池:
①负极材料为: ;负极反应: ;
②正极材料为: 电解质溶液为: 正极反应:
③画出原电池简图:
①负极材料为:
②正极材料为:
③画出原电池简图:
考点:原电池和电解池的工作原理
专题:电化学专题
分析:Zn+Cu2+=Cu+Zn2+设计成原电池,Zn做负极,发生氧化反应,Cu做正极,铜离子在铜电极上发生还原反应,电解质溶液为硫酸铜溶液,据此分析.
解答:
解:Zn+Cu2+=Cu+Zn2+设计成原电池,Zn做负极,发生氧化反应,Cu做正极,铜离子在铜电极上发生还原反应,电解质溶液为硫酸铜溶液,
①负极材料为锌,负极反应:Zn-2e-=Zn2+,故答案为:Zn;Zn-2e-=Zn2+;
②正极材料为铜或惰性电极,电解质溶液为电解质溶液可以是硫酸铜溶液,电极反应式为:Cu或C;CuSO4溶液;Cu2++2e-=Cu;
③原电池简图:可设计如下两个装置:第一个装置中电解质溶液是CuSO4溶液,第二个装置中使用了盐桥,如图: ,
,
答:图为 .
.
①负极材料为锌,负极反应:Zn-2e-=Zn2+,故答案为:Zn;Zn-2e-=Zn2+;
②正极材料为铜或惰性电极,电解质溶液为电解质溶液可以是硫酸铜溶液,电极反应式为:Cu或C;CuSO4溶液;Cu2++2e-=Cu;
③原电池简图:可设计如下两个装置:第一个装置中电解质溶液是CuSO4溶液,第二个装置中使用了盐桥,如图:
 ,
,答:图为
 .
.
点评:本题考查了原电池原理以及设计原电池,设计原电池是解题的关键,题目难度中等.

练习册系列答案
相关题目
下列试剂的保存方法正确的是( )
| A、氢氟酸存放在玻璃瓶中 |
| B、烧碱溶液存放在带橡皮塞的玻璃瓶中 |
| C、水玻璃存放在滴瓶中 |
| D、金属钠保存在冷水里 |
工业废水中常含有Cu2+、Cd2+、Pb2+等重金属离子,可通过加入过量的难溶电解质 FeS、MnS,使这些金属离子形成硫化物沉淀除去.根据以上事实,可推知FeS、MnS具有的相关性质是( )
| A、在水中的溶解能力大于CuS、CdS、PbS |
| B、在水中的溶解能力小于CuS、CdS、PbS |
| C、在水中的溶解能力与CuS、CdS、PbS相同 |
| D、二者均具有较强的吸附性 |
下列说法不正确的是( )
| A、用水鉴别乙醇、甲苯和溴苯 |
| B、用燃烧法鉴别乙醇、苯和四氯化碳 |
| C、用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 |
| D、纤维素在人体内可水解为葡萄糖,故可作人类的营养物质 |
碳原子之间只以单键结合的饱和链烃的通式为( )
| A、CnH2n+2 |
| B、CnH2n |
| C、CnH2n-2 |
| D、CnHn |
对于铜--锌原电池(如图),以下说法不正确的是( )
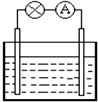

| A、铜为正极 |
| B、锌片上发生氧化反应 |
| C、它是一种把化学能转变为电能的装置 |
| D、电子从铜片流出沿导线流入锌片 |
有Na2O、Na2O2、Na2CO3、NaHCO3、NaCl中的某几种组成的混合物,向混合物中加入足量的盐酸有气体放出,将放出的气体通过过量的NaOH溶液后,气体体积有所减少,若将上述混合物在空气中充分加热,也有气体放出,且加热后残留固体物质的质量比加热前增加,下列推断正确的是( )
| A、混合物中一定不含有Na2O |
| B、混合物中一定不含有Na2CO3和NaCl |
| C、混合物中肯定含Na2O2、Na2O2和NaHCO3 |
| D、混合物中一定不含有Na2O2和NaCl |