题目内容
 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入Fe粉,溶液中Fe2+浓度和加入Fe粉的物质的量之间的关系如如图所示.则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入Fe粉,溶液中Fe2+浓度和加入Fe粉的物质的量之间的关系如如图所示.则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )| A、1:1:1 |
| B、1:1:4 |
| C、1:2:2 |
| D、3:2:8 |
考点:离子方程式的有关计算
专题:计算题
分析:溶液中含有Fe (NO3) 3、Cu (NO3) 2、HNO3,氧化性顺序为:HNO3>Fe (NO3) 3>Cu (NO3) 2,加入铁后依次反应;依据氧化还原反应的顺序规律结合图象 分析计算.
分析计算.
 分析计算.
分析计算.解答:
解:稀溶液中各物质的氧化性顺序为:HNO3>Fe (NO3) 3>Cu (NO3) 2,加入铁后会依次发生氧化还原反应,
①Fe+4HNO3=Fe(NO3)3+NO↑+2H2O、②Fe+2Fe3+=3Fe2+、③Fe+Cu2+=Cu+Fe2+,
从图象中可知铁为1mol时,无Fe2+生成,发生的反应是①消耗硝酸为4mol,生成Fe3+1mol;
再加入1mol铁发生反应②生成Fe2+物质的量为3mol,反应的Fe3+物质的量为2mol,其中原溶液中的Fe3+物质的量1mol;
再加入1mol铁发生反应③,此时又生成Fe2+物质的量为1mol,说明原溶液中Cu2+物质的量为1mol;
综上所述可知原溶液中Fe (NO3) 3为1mol,Cu (NO3) 2物质的量为1mol,HNO3物质的量为4mol,物质的量浓度之比为:1:1:4,
故选B.
①Fe+4HNO3=Fe(NO3)3+NO↑+2H2O、②Fe+2Fe3+=3Fe2+、③Fe+Cu2+=Cu+Fe2+,
从图象中可知铁为1mol时,无Fe2+生成,发生的反应是①消耗硝酸为4mol,生成Fe3+1mol;
再加入1mol铁发生反应②生成Fe2+物质的量为3mol,反应的Fe3+物质的量为2mol,其中原溶液中的Fe3+物质的量1mol;
再加入1mol铁发生反应③,此时又生成Fe2+物质的量为1mol,说明原溶液中Cu2+物质的量为1mol;
综上所述可知原溶液中Fe (NO3) 3为1mol,Cu (NO3) 2物质的量为1mol,HNO3物质的量为4mol,物质的量浓度之比为:1:1:4,
故选B.
点评:本题考查了有关离子方程式的计算,题目难度中等,涉及铁及其化合物的性质应用,主要考查氧化还原反应的顺序反应规律及计算应用,明确图象曲线变化的含义为解答关键,试题有利于培养学生的分析能力及化学计算能力.

练习册系列答案
相关题目
对于铜--锌原电池(如图),以下说法不正确的是( )
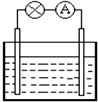

| A、铜为正极 |
| B、锌片上发生氧化反应 |
| C、它是一种把化学能转变为电能的装置 |
| D、电子从铜片流出沿导线流入锌片 |
将0.10mol?L-1的盐酸逐滴加入0.10mol?L-1的氨水,滴加过程中不可能出现的结果是( )
| A、c(NH4+)>c(Cl-),c(OH-)>c(H+) |
| B、c(NH4+)=c(Cl-),c(OH-)=c(H+) |
| C、c(Cl-)>c(NH4+),c(OH-)>c(H+) |
| D、c(Cl-)>c(NH4+),c(H+)>c(NH4+) |
三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2.其反应原理为:C3N3(OH)3
3HNCO; 8HNCO+6NO2
7N2+8CO2+4H2O下列说法正确的是( )
| ||
| ||
| A、C3N3(OH)3与HNCO为同一物质 |
| B、HNCO是一种很强的氧化剂 |
| C、1 mol NO2在反应中转移的电子为24 mol |
| D、反应中N2既是氧化产物又是还原产物 |
下列反应的离子方程式书写正确的是( )
| A、用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ |
| B、氯气通入澄清石灰水中:Cl2+2OH-═Cl-+ClO-+H2O |
| C、SO2气体通入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO |
| D、硅酸钠溶液中通入过量二氧化碳:SiO32-+CO2+H2O═H2SiO3↓+CO32- |
按C、N、O、F的顺序,其元素的性质表现为递增的是( )
| A、金属性 | B、失电子能力 |
| C、得电子能力 | D、单质还原性 |