题目内容
已知20℃下,AgCl和AgBr的溶解度分别为1.5×10-4g、8.4×10-6g.分别取AgCl和AgBr饱和溶液的上层清夜,按体积比1:1充分混合,再加入足量浓AgNO3溶液,则( )
| A、加浓AgNO3前,混合溶液中肯定没有沉淀析出 |
| B、加浓AgNO3前,混合溶液中AgCl、AgBr均已达到饱和 |
| C、加浓AgNO3后,得到两种沉淀,以AgBr沉淀为主 |
| D、加浓AgNO3后,得到两种沉淀,以AgCl沉淀为主 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:盐类的水解专题
分析:向AgCl与AgBr的饱和溶液中,加入AgNO3,AgCl与AgBr的溶解平衡向左移动,但AgBr的溶解度更小,溶液中AgCl沉淀较多.
解答:
解:AgCl和AgBr的溶解度分别为1.5×10-4g、8.4×10-6g,在AgCl和AgBr两饱和溶液中,前者c(Ag+)大于后者c(Ag+),c(Cl-)>c(Br-),当将AgCl、AgBr两饱和溶液混合时,发生沉淀的转化,生成更多的AgBr沉淀,与此同时,溶液中n(Cl-)比原来AgCl饱和溶液中大,当加入足量的浓AgNO3溶液时,AgBr沉淀有所增多,但AgCl沉淀增加更多.
故选D.
故选D.
点评:本题考查难溶电解质的溶解平衡,题目难度中等,解答本题时注意AgCl的溶解度比AgBr大,加入硝酸银,抑制溶解平衡向右移动,生成沉淀更多.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列物质属于同分异构体的一组是( )
| A、CH4与C2H4 |
B、 与 CH3-CH2-CH2-CH3 与 CH3-CH2-CH2-CH3 |
| C、C2H6与C3H8 |
| D、O2与O3 |
有些单质,易溶于含同一元素的盐溶液中,如:硫易溶于硫化钾溶液中,对于由①CaCO3、②KI、③Al(OH)3、④AgOH(Ag2O)、⑤I2五种物质所组成的混合物,要使其每种成分逐一溶解(一次只溶解一种物质),试剂选用顺序正确的是( )
| A、氨水 乙醇 水 氢氧化钾 硝酸 |
| B、四氯化碳 水 氨水 氢氧化钠 盐酸 |
| C、水 苯 氨水 氢氧化钾 硝酸 |
| D、水 盐酸 氢氧化钠 氨水 乙醇 |
工业废水中常含有Cu2+、Cd2+、Pb2+等重金属离子,可通过加入过量的难溶电解质 FeS、MnS,使这些金属离子形成硫化物沉淀除去.根据以上事实,可推知FeS、MnS具有的相关性质是( )
| A、在水中的溶解能力大于CuS、CdS、PbS |
| B、在水中的溶解能力小于CuS、CdS、PbS |
| C、在水中的溶解能力与CuS、CdS、PbS相同 |
| D、二者均具有较强的吸附性 |
下列仪器中,不能用于加热的是( )
| A、蒸发皿 | B、试管 |
| C、圆底烧瓶 | D、容量瓶 |
下列说法不正确的是( )
| A、用水鉴别乙醇、甲苯和溴苯 |
| B、用燃烧法鉴别乙醇、苯和四氯化碳 |
| C、用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 |
| D、纤维素在人体内可水解为葡萄糖,故可作人类的营养物质 |
对于铜--锌原电池(如图),以下说法不正确的是( )
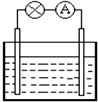

| A、铜为正极 |
| B、锌片上发生氧化反应 |
| C、它是一种把化学能转变为电能的装置 |
| D、电子从铜片流出沿导线流入锌片 |
将0.10mol?L-1的盐酸逐滴加入0.10mol?L-1的氨水,滴加过程中不可能出现的结果是( )
| A、c(NH4+)>c(Cl-),c(OH-)>c(H+) |
| B、c(NH4+)=c(Cl-),c(OH-)=c(H+) |
| C、c(Cl-)>c(NH4+),c(OH-)>c(H+) |
| D、c(Cl-)>c(NH4+),c(H+)>c(NH4+) |
