题目内容
将过氧化钠和过量的碳酸氢钠在密闭容器中混合充分加热后,最终残留固体物质是( )
| A、Na2CO3 |
| B、Na2O和Na2O2 |
| C、Na2O2 |
| D、Na2O2和Na2CO3 |
考点:钠的重要化合物
专题:元素及其化合物
分析:加热时碳酸氢钠分解生成二氧化碳和水,分别与过氧化钠反应生成碳酸钠和氢氧化钠,当碳酸氢钠过量时,生成二氧化碳过量,最终产物为碳酸钠.
解答:
解:加热时碳酸氢钠分解生成二氧化碳和水,二氧化碳和水与过氧化钠反应,当碳酸氢钠过量时,生成二氧化碳、水均过量,则反应后生成的固体中不可能存在过氧化钠,过氧化钠先与二氧化碳反应,则最终产物为碳酸钠.
故选A.
故选A.
点评:本题考查钠的重要化合物,题目难度不大,注意过氧化钠的性质.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案
相关题目
下列仪器中,不能用于加热的是( )
| A、蒸发皿 | B、试管 |
| C、圆底烧瓶 | D、容量瓶 |
下列描述中,错误的是( )
| A、电解熔融的氧化铝制取金属铝,用铁作阳极 |
| B、电解法精炼粗铜,用纯铜作阴极 |
| C、钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-=4OH- |
| D、在镀件上电镀锌,用锌作阳极 |
对于铜--锌原电池(如图),以下说法不正确的是( )
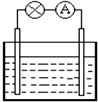

| A、铜为正极 |
| B、锌片上发生氧化反应 |
| C、它是一种把化学能转变为电能的装置 |
| D、电子从铜片流出沿导线流入锌片 |
下列热化学方程式正确的是(△H的绝对值均正确)( )
| A、2NO2?N2O4△H=-57kJ/mol(反应热) | ||
B、
| ||
| C、S(s)+O2(g)═SO2(g)△H=+269.8kJ/mol(反应热) | ||
D、C8H18(l)+
|
硅和碳的性质比较,下列说法正确的是( )
| A、晶体硅和金刚石晶体结构相似,但晶体硅的硬度比金刚石小 |
| B、硅和碳都有+4价、+2价、-4价 |
| C、硅的化合物种类比碳的化合物种类多 |
| D、碳和硅在自然界都既能以游离态存在,又能以化合态存在 |
下列反应的离子方程式书写正确的是( )
| A、用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ |
| B、氯气通入澄清石灰水中:Cl2+2OH-═Cl-+ClO-+H2O |
| C、SO2气体通入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO |
| D、硅酸钠溶液中通入过量二氧化碳:SiO32-+CO2+H2O═H2SiO3↓+CO32- |
