题目内容
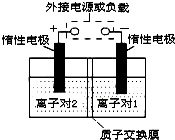 全钒液流储能电池,是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置.现将钒的相关化合物溶解在pH=1的稀硫酸中,按下图组装一个模拟电池.
全钒液流储能电池,是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置.现将钒的相关化合物溶解在pH=1的稀硫酸中,按下图组装一个模拟电池.注:(1)如图中的离子对1为V2+(紫色)/V3+(绿色);离子对2为VO2+ (蓝色)/VO2+(黄色);
(2)质子交换膜只允许质子通过.
(1)当左槽溶液逐渐由黄变蓝,其电极反应式为
(2)在这个二次电池中,氢离子的作用是
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)左槽溶液逐渐由黄变蓝,VO2+转变为VO2+,发生还原反应,应为原电池的负极,放电过程中,右槽是电源负极,电极反应式为V2+-e-=V3+,V3+为绿色;
(2)充电时,左槽发生的反应为VO2++H2O-e-=VO2++2H+当转移电子为3.01×1025个即为50 mol电子时,生成氢离子为50 mol.
(2)充电时,左槽发生的反应为VO2++H2O-e-=VO2++2H+当转移电子为3.01×1025个即为50 mol电子时,生成氢离子为50 mol.
解答:
解:(1)当左槽溶液逐渐由黄变蓝,其电极反应式为VO2++2H++e-=VO2++H2O,说明此时为原电池,且为原电池的正极,放电过程中,右槽是电源负极,电极反应式为V2+-e-=V3+,V3+为绿色,V2+为紫色,故可以看到右槽溶液颜色逐渐由紫色变为绿色,
故答案为:VO2++2H++e-=VO2++H2O;B;绿;
(2)放电过程中,电极反应式为VO2++2H++e-=VO2++H2O,氢离子的作用是充电时,参与正极反应,通过交换膜定向移动使电流通过溶液,平衡两槽内溶液的电性;左槽发生的反应为VO2++H2O=VO2++2H++e-,当转移电子为1.204×1023个即为0.2 mol电子时,生成氢离子为0.2mol,氢离子变化0.2mol,
故答案为:参与正极反应;平衡两槽内溶液的电性;0.2mol.
故答案为:VO2++2H++e-=VO2++H2O;B;绿;
(2)放电过程中,电极反应式为VO2++2H++e-=VO2++H2O,氢离子的作用是充电时,参与正极反应,通过交换膜定向移动使电流通过溶液,平衡两槽内溶液的电性;左槽发生的反应为VO2++H2O=VO2++2H++e-,当转移电子为1.204×1023个即为0.2 mol电子时,生成氢离子为0.2mol,氢离子变化0.2mol,
故答案为:参与正极反应;平衡两槽内溶液的电性;0.2mol.
点评:本题考查了化学反应方程式和反应前后物质的量浓度的变化列方程求解起始反应物的浓度,并计算相应物质的化学反应速率,关于电池,在原电池中负极失去电子,为还原剂发生氧化反应,正极得到电子,为氧化剂发生还原反应,在电解池中,与电源正极相连为阳极,发生氧化反应,失去电子,与电源负极相连的阴极,发生还原反应,得到电子.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
下列物质属于同分异构体的一组是( )
| A、CH4与C2H4 |
B、 与 CH3-CH2-CH2-CH3 与 CH3-CH2-CH2-CH3 |
| C、C2H6与C3H8 |
| D、O2与O3 |
下列说法不正确的是( )
| A、用水鉴别乙醇、甲苯和溴苯 |
| B、用燃烧法鉴别乙醇、苯和四氯化碳 |
| C、用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 |
| D、纤维素在人体内可水解为葡萄糖,故可作人类的营养物质 |
对于铜--锌原电池(如图),以下说法不正确的是( )
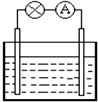

| A、铜为正极 |
| B、锌片上发生氧化反应 |
| C、它是一种把化学能转变为电能的装置 |
| D、电子从铜片流出沿导线流入锌片 |
有Na2O、Na2O2、Na2CO3、NaHCO3、NaCl中的某几种组成的混合物,向混合物中加入足量的盐酸有气体放出,将放出的气体通过过量的NaOH溶液后,气体体积有所减少,若将上述混合物在空气中充分加热,也有气体放出,且加热后残留固体物质的质量比加热前增加,下列推断正确的是( )
| A、混合物中一定不含有Na2O |
| B、混合物中一定不含有Na2CO3和NaCl |
| C、混合物中肯定含Na2O2、Na2O2和NaHCO3 |
| D、混合物中一定不含有Na2O2和NaCl |
下列热化学方程式正确的是(△H的绝对值均正确)( )
| A、2NO2?N2O4△H=-57kJ/mol(反应热) | ||
B、
| ||
| C、S(s)+O2(g)═SO2(g)△H=+269.8kJ/mol(反应热) | ||
D、C8H18(l)+
|
将0.10mol?L-1的盐酸逐滴加入0.10mol?L-1的氨水,滴加过程中不可能出现的结果是( )
| A、c(NH4+)>c(Cl-),c(OH-)>c(H+) |
| B、c(NH4+)=c(Cl-),c(OH-)=c(H+) |
| C、c(Cl-)>c(NH4+),c(OH-)>c(H+) |
| D、c(Cl-)>c(NH4+),c(H+)>c(NH4+) |