题目内容
2.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )| A. | 标准状态下,22.4LSO3含有原子数为4NA | |
| B. | 4℃时,18gH2O含有2NA 个非极性键 | |
| C. | 1molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA | |
| D. | 将含1molFeCl3的饱和溶液滴入沸水形成的胶体粒子的数目为NA |
分析 A.在标准状况下,SO3的状态不是气体,不能使用标况下的气体摩尔体积计算三氧化硫的物质的量;
B.物质的量n=$\frac{m}{M}$,水分子中含两个极性键;
C.氧化钠是由钠离子和氧离子构成,过氧化钠是钠离子和过氧根离子构成;
D.水解程度很小,且1个氢氧化铁胶粒是多个氢氧化铁分子的聚集体.
解答 解:A.在标准状况下,三氧化硫不是气体,题中条件无法计算22.4LSO3的物质的量,故A错误;
B.水分子中不含非极性键,故B错误;
C.1mol Na2O和Na2O2的混合物中含有2mol钠离子和1mol阴离子,总共含有3mol阴阳离子,含有的阴、阳离子总数是3NA,故C正确;
D.将含1 mol FeCl3的饱和溶液滴入沸水形成的胶体,由于盐水解程度是微弱的,而且胶体粒子是许多Fe(OH)3的集合体,所以胶体粒子的数目小于1NA,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,题目难度不大.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案
相关题目
13.甲酸(HCOOH)是一种一元弱酸,下列性质中可以证明它是弱电解质的是( )
| A. | 常温下,1 mol/L甲酸溶液中的c(H+)约为1×10-2mol•L-1 | |
| B. | 甲酸能与碳酸钠反应放出二氧化碳 | |
| C. | 10 mL 1 mol•L-1甲酸溶液恰好与10 mL 1 mol•L-1NaOH溶液完全反应 | |
| D. | 甲酸溶液与锌反应比强酸溶液与锌反应缓慢 |
17.我国古代文献中有许多化学知识的记载,如《梦溪笔谈》中的“信州铅山县有苦泉,…,挹其水熬之,则成胆矾,熬胆矾铁釜,久之亦化为铜”等,上述描述中没有涉及到的化学反应类型是( )
| A. | 复分解反应 | B. | 化合反应 | C. | 离子反应 | D. | 氧化还原反应 |
7.短周期主族元素X、Y、Z、W的原子序数依次增大,Y原子核外电子数是X原子最外层电子数的2倍,Y、W同主族,离子化合物ZY不溶于水.下列叙述正确的是( )
| A. | 离子半径:W>Y>Z | |
| B. | Z的单质不能与水反应 | |
| C. | 简单氢化物的沸点:W>Y | |
| D. | 最高价氧化物对应的水化物的酸性:X>W |
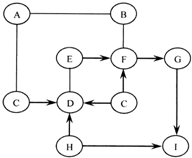 图中A~I是初中化学常见的物质,且分别是由H、C、O、Na、Al、S、Ca、Cu、Ag中的一种或几种元素组成的.
图中A~I是初中化学常见的物质,且分别是由H、C、O、Na、Al、S、Ca、Cu、Ag中的一种或几种元素组成的.