题目内容
13.甲酸(HCOOH)是一种一元弱酸,下列性质中可以证明它是弱电解质的是( )| A. | 常温下,1 mol/L甲酸溶液中的c(H+)约为1×10-2mol•L-1 | |
| B. | 甲酸能与碳酸钠反应放出二氧化碳 | |
| C. | 10 mL 1 mol•L-1甲酸溶液恰好与10 mL 1 mol•L-1NaOH溶液完全反应 | |
| D. | 甲酸溶液与锌反应比强酸溶液与锌反应缓慢 |
分析 如果能说明甲酸在水溶液里部分电离就能证明甲酸是弱电解质,据此分析解答.
解答 解:A.1mol/L甲酸溶液中c(H+)=0.01mol/L<1mol/L,说明甲酸部分电离,所以能证明甲酸是弱电解质,故A正确;
B.甲酸能与碳酸钠反应放出二氧化碳是梦甲酸酸性强于碳酸,但不能说明甲酸为弱酸,故B错误;
C.10ml 1mol/L甲酸恰好与10ml•1mol/L NaOH溶液完全反应,说明甲酸是一元酸,不能说明甲酸部分电离,所以不能证明甲酸是弱电解质,故C错误;
D.甲酸和强酸溶液中氢离子浓度大小决定反应速率,浓度不知不能证明甲酸是弱酸,故D错误;
故选A.
点评 本题考查弱电解质的判断,知道强弱电解质的本质区别是“电离程度”,电解质强弱只根据电离程度判断,不能根据其溶解性强弱判断,题目难度不大.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
8.用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 1mol Cu与足量稀硝酸反应产生NA个NO分子 | |
| B. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol•L-1 | |
| C. | 通常条件下,7.1g 37Cl2含中子数为4.0NA | |
| D. | 2.4g Mg在足量O2中燃烧,转移的电子数为0.2NA |
4.下列说法中正确的是( )
| A. | 1 mol稀硫酸和1 mol稀Ba(OH)2溶液完全中和所放出的热量为中和热 | |
| B. | 中和反应都是放热反应,多数分解反应是吸热反应 | |
| C. | 在101 kPa时,1 mol碳燃烧所放出的热量一定是碳的燃烧热 | |
| D. | 碳与二氧化碳的反应既是放热反应,也是化合反应 |
1.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,0.1mol二氧化硅中所含硅氧键数目为0.2NA | |
| B. | 50mL12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 常温常压下,46gNO2含有原子数为3 NA(相对原子质量N:14 O:16) | |
| D. | 标准状况下,11.2LSO3含有分子数为0.5NA |
18.下列实验操作正确的是( )
| A. | 用水不能区别酒精、苯和四氯化碳 | |
| B. | 制取蒸馏水时,为了防止瓶内产生暴沸现象,应先向烧瓶内加入几片碎瓷片 | |
| C. | 做CO还原Fe2O3实验时,为防止CO污染环境,实验完毕,常先停止通CO,再停止加热 | |
| D. | 在用水吸收HCl气体时可把导管直接插入液面下 |
2.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 标准状态下,22.4LSO3含有原子数为4NA | |
| B. | 4℃时,18gH2O含有2NA 个非极性键 | |
| C. | 1molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA | |
| D. | 将含1molFeCl3的饱和溶液滴入沸水形成的胶体粒子的数目为NA |
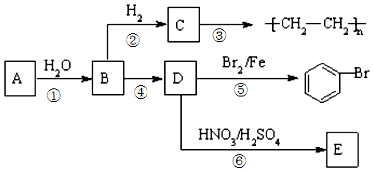
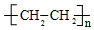 ;⑥
;⑥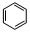 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$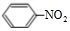 +H2O.
+H2O. ;
; .
. 请填写下列空白:
请填写下列空白: