题目内容
14.FeCl3可用作印刷电路铜板腐蚀剂和外伤止血剂等(1)若要溶解电路板上3.2g的铜,则至少需要1 mol•L-1 FeCl3溶液的体积为100mL.
(2)检验腐蚀电路铜板后的溶液中是否存在Fe 3+的试剂是KSCN溶液.
(3)腐蚀电路铜板后的溶液中铜元素含量的测定:
取20.00mL腐蚀电路铜板后的溶液于碘量瓶中,先加足量NaF(发生的反应为Fe3++6F-=[FeF6]3-),再加足量的10%KI溶液,摇匀.塞上碘量瓶瓶塞,置于暗处5min,充分反应后(有CuI沉淀生成),加几滴淀粉溶液,用0.1000 mol•L-1Na2S2O3标准溶液滴定到终点时,共消耗20.00mL标准液.测定过程中有关物质的转化关系如下:
Cu2+$\stackrel{I-}{→}$I2$\stackrel{S_{2}O_{3}^2-}{→}$S4O62-
①若测定过程中碘量瓶敞口置于暗处5min,会导致测定结果偏高(填:“偏高”、“偏低”、“无影响”).
②计算该腐蚀液中铜元素的含量(用g•L-1表示),写出计算过程.
分析 (1)化学方程式为:2FeCl3+Cu=2FeCl2+CuCl2 ,结合化学方程式定量关系计算得到;
(2)三价铁离子的实验验证方法和现象分析,铁离子结合硫氰酸根离子形成血红色溶液;
(3)①若测定过程中碘量瓶敞口置于暗处5min,空气中氧气氧化碘离子为碘单质,消耗标准溶液物质的量增大;
②定量关系得到,2Cu2+~I2~2S2O32-,据此计算;
解答 解:(1)依据反应2FeCl3+Cu=2FeCl2+CuCl2,溶解电路板上3.2g的铜物质的量=$\frac{3.2g}{64g/mol}$=0.05mol,反应消耗氯化铁0.1mol,溶液体积V=$\frac{0.1mol}{1mol/L}$=0.1L=100ml,
故答案为:100;
(2)验证废液中是否存在Fe3+的试剂是KSCN溶液,溶液呈血红色证明是含有铁离子,
故答案为:KSCN溶液;
(3)①若测定过程中碘量瓶敞口置于暗处5min,空气中氧气氧化碘离子为碘单质,消耗标准溶液物质的量增大,会导致测定结果偏高,
故答案为:偏高;
②依据反应的定量关系得到,2Cu2+~I2~2S2O32-,
20.00mL中:n(Cu2+)=n(S2O32-)=0.1000 mol•L-1×0.0200L=0.002mol,
铜元素的含量为$\frac{0.002mol×64g/mol}{0.02L}$×100%=6.4 g/L,
答:定量关系得到,2Cu2+~I2~2S2O32-,
20.00mL中:n(Cu2+)=n(S2O32-)=0.1000 mol•L-1×0.0200L=0.002mol,
铜元素的含量为$\frac{0.002mol×64g/mol}{0.02L}$×100%=6.4 g/L,该腐蚀液中铜元素的含量为6.4 g/L.
点评 本题考查了铁及其化合物性质的应用、滴定实验的定量计算、实验验证离子性质,掌握基础是关键,题目难度中等.

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案| A. | 1 mol稀硫酸和1 mol稀Ba(OH)2溶液完全中和所放出的热量为中和热 | |
| B. | 中和反应都是放热反应,多数分解反应是吸热反应 | |
| C. | 在101 kPa时,1 mol碳燃烧所放出的热量一定是碳的燃烧热 | |
| D. | 碳与二氧化碳的反应既是放热反应,也是化合反应 |
| A. | 标准状态下,22.4LSO3含有原子数为4NA | |
| B. | 4℃时,18gH2O含有2NA 个非极性键 | |
| C. | 1molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA | |
| D. | 将含1molFeCl3的饱和溶液滴入沸水形成的胶体粒子的数目为NA |
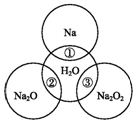 如图两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )
如图两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )| A. | 反应③最多能产生0.1 mol O2 | |
| B. | 反应①的离子方程式为Na+2H2O═Na++2OH-+H2↑ | |
| C. | Na2O2中阴阳离子数目之比为1:1 | |
| D. | ①②③充分反应后所得溶液中溶质的质量分数:②=③>① |
| A. | 在粗盐提纯中,当加热到蒸发皿中有较多固体析出,残留少量液体时,停止加热,用余热将液体蒸干 | |
| B. | 当振荡分液漏斗中的混合溶液时,须用一只手压住分液漏斗的玻璃塞,另一只手握住旋塞,将分液漏斗倒转过来,用力振荡 | |
| C. | 粗盐提纯得到精盐的过程一定需要两次过滤操作 | |
| D. | 实验过程中若皮肤不慎沾上少量碱液,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗 |
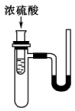 如图小试管中盛有几毫升水,与大试管连通的U形管内放有少量水(已染成红色).如沿小试管壁慢慢注入3mL浓硫酸,静置后,U形管中可观察到的现象是液面( )
如图小试管中盛有几毫升水,与大试管连通的U形管内放有少量水(已染成红色).如沿小试管壁慢慢注入3mL浓硫酸,静置后,U形管中可观察到的现象是液面( )| A. | 左高右低 | B. | 左低右高 | C. | 左右一样高 | D. | 来回振动 |
:

(1)①中反应的离子方程式是3Mg(OH)2+2Fe3+=2Fe(OH)3(胶体)+3Mg2+.
(2)②中逸出的无色气体是CO2.
(3)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
Ⅰ.甲取③中的红棕色溶液少许,滴入少量盐酸酸化的BaCl2溶液,产生白色沉淀. 甲得出结论:FeCl3与Na2SO3发生了氧化还原反应,离子方程式是2Fe3++SO32-+H2O=2Fe2++SO42-+2H+.
Ⅱ.乙认为甲的实验不严谨,重新设计并进行实验,证实了甲的结论是正确的.其实验方案是取Ⅰ中所得溶液少许进行亚铁离子(或Fe2+)离子的检验.
(4)受以上实验的启发,同学们对pH≈8的1mol/LNaF溶液与FeCl3溶液混合时的现象产生了好奇并进行实验:
| 实验操作及现象 | ④向2mL0.2mol/L FeCl3溶液中滴入2mL1mol/LNaF溶液.溶液变无色 |
| ⑤向2mL0.2mol/L FeCl3溶液中滴入2mL蒸馏水,溶液颜色变浅 |
Ⅱ.为探究④中溶液变无色的原因,进行如下实验:
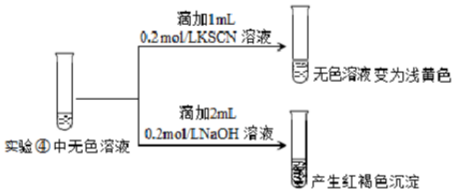
资料显示:FeF3溶液为无色.
用平衡移动原理解释红褐色沉淀产生的原因:无色溶液中存在平衡:Fe3++3F-?FeF3,加入NaOH后,Fe3+更易与OH-结合生成难溶的Fe(OH)3.
(5)根据实验,FeCl3溶液与碱性物质之间的反应的多样性与碱性物质的pH、离子的性质有关.
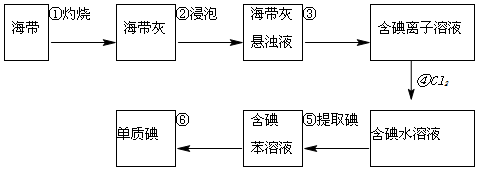 请填写下列空白:
请填写下列空白: