题目内容
17.我国古代文献中有许多化学知识的记载,如《梦溪笔谈》中的“信州铅山县有苦泉,…,挹其水熬之,则成胆矾,熬胆矾铁釜,久之亦化为铜”等,上述描述中没有涉及到的化学反应类型是( )| A. | 复分解反应 | B. | 化合反应 | C. | 离子反应 | D. | 氧化还原反应 |
分析 发生CuSO4+5H2O=CuSO4.5H2O、CuSO4.5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+5H2O、Fe+CuSO4=Cu+FeSO4,以此解答.
解答 解:CuSO4+5H2O=CuSO4.5H2O为化合反应,
CuSO4.5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+5H2O为分解反应,
Fe+CuSO4=Cu+FeSO4为置换反应,且Fe、Cu元素的化合价变化,为氧化还原反应,
故选A.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应及分类为解答的关键,侧重分析与应用能力的考查,注意基本反应类型及氧化还原反应的判断方法,题目难度不大.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
7.下列说法正确的是( )
| A. | 1 mol任何气体的摩尔体积都约是22.4 L | |
| B. | 标准状况时,体积均为22.4 L的O2与CO2含有相同的分子数 | |
| C. | 处于标准状况的两种气体,当体积均为22.4 L时的质量完全相同 | |
| D. | 标准状况时,2 mol任何物质的体积均约为44.8 L |
12.分类法是重要的科学研究方法,下列物质归类正确的是( )
| A. | 碱:苛性钠、纯碱、熟石灰 | |
| B. | 盐:胆矾、小苏打、铜绿 | |
| C. | 碱性氧化物:氧化铜、七氧化二锰、氧化铝 | |
| D. | 无丁达尔现象的分散系:碘的四氧化碳溶液、淀粉溶液、氯化铁溶液 |
2.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 标准状态下,22.4LSO3含有原子数为4NA | |
| B. | 4℃时,18gH2O含有2NA 个非极性键 | |
| C. | 1molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA | |
| D. | 将含1molFeCl3的饱和溶液滴入沸水形成的胶体粒子的数目为NA |
9.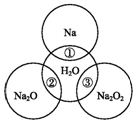 如图两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )
如图两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )
 如图两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )
如图两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )| A. | 反应③最多能产生0.1 mol O2 | |
| B. | 反应①的离子方程式为Na+2H2O═Na++2OH-+H2↑ | |
| C. | Na2O2中阴阳离子数目之比为1:1 | |
| D. | ①②③充分反应后所得溶液中溶质的质量分数:②=③>① |
6.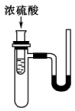 如图小试管中盛有几毫升水,与大试管连通的U形管内放有少量水(已染成红色).如沿小试管壁慢慢注入3mL浓硫酸,静置后,U形管中可观察到的现象是液面( )
如图小试管中盛有几毫升水,与大试管连通的U形管内放有少量水(已染成红色).如沿小试管壁慢慢注入3mL浓硫酸,静置后,U形管中可观察到的现象是液面( )
 如图小试管中盛有几毫升水,与大试管连通的U形管内放有少量水(已染成红色).如沿小试管壁慢慢注入3mL浓硫酸,静置后,U形管中可观察到的现象是液面( )
如图小试管中盛有几毫升水,与大试管连通的U形管内放有少量水(已染成红色).如沿小试管壁慢慢注入3mL浓硫酸,静置后,U形管中可观察到的现象是液面( )| A. | 左高右低 | B. | 左低右高 | C. | 左右一样高 | D. | 来回振动 |
7.在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如表:下列说法错误的是( )
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为50% | |
| B. | 反应可表示为X+3Y?2Z | |
| C. | 改变温度可以改变此反应的平衡常数 | |
| D. | 增大压强使平衡向生成Z的方向移动,平衡常数增大 |
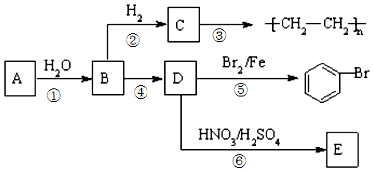
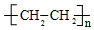 ;⑥
;⑥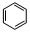 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$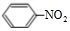 +H2O.
+H2O. ;
; .
.