题目内容
7.短周期主族元素X、Y、Z、W的原子序数依次增大,Y原子核外电子数是X原子最外层电子数的2倍,Y、W同主族,离子化合物ZY不溶于水.下列叙述正确的是( )| A. | 离子半径:W>Y>Z | |
| B. | Z的单质不能与水反应 | |
| C. | 简单氢化物的沸点:W>Y | |
| D. | 最高价氧化物对应的水化物的酸性:X>W |
分析 短周期主族元素X、Y、Z、W的原子序数依次增大,Y、W同主族,Y为O,W为S,离子化合物ZY为MgO,不溶于水,可知Z为Mg,Y原子核外电子数是X原子最外层电子数的2倍,则X的最外层电子数为$\frac{8}{2}$=4,可知X为C,以此来解答.
解答 解:由上述分析可知,X为C,Y为O,Z为Mg,W为S,
A.电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则离子半径:W>Y>Z,故A正确;
B.Mg与水加热下缓慢反应,故B错误;
C.水中含氢键,则简单氢化物的沸点:W<Y,故C错误;
D.非金属性S>C,则最高价氧化物对应的水化物的酸性:X<W,故D错误;
故选A.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素化合物推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
17.表是几种弱酸常温下的电离平衡常数:
(1)①CH3COOH、②H2CO3、③H2S、④H3PO4四种酸的酸性由强到弱的顺序为(填序号)④①②③.
(2)同浓度的①CH3COO-②HCO3-③CO32-④S2-结合H+的能力由强到弱的顺序为(填序号)④③②①.
| ①CH3COOH | ②H2CO3 | ③H2S | ④H3PO4 |
| K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
(2)同浓度的①CH3COO-②HCO3-③CO32-④S2-结合H+的能力由强到弱的顺序为(填序号)④③②①.
18.下列实验操作正确的是( )
| A. | 用水不能区别酒精、苯和四氯化碳 | |
| B. | 制取蒸馏水时,为了防止瓶内产生暴沸现象,应先向烧瓶内加入几片碎瓷片 | |
| C. | 做CO还原Fe2O3实验时,为防止CO污染环境,实验完毕,常先停止通CO,再停止加热 | |
| D. | 在用水吸收HCl气体时可把导管直接插入液面下 |
2.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 标准状态下,22.4LSO3含有原子数为4NA | |
| B. | 4℃时,18gH2O含有2NA 个非极性键 | |
| C. | 1molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA | |
| D. | 将含1molFeCl3的饱和溶液滴入沸水形成的胶体粒子的数目为NA |
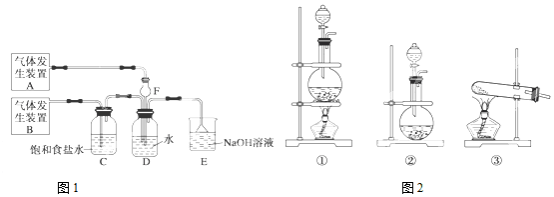
12.能用如图所示装置实施的气体制取方案是( )


| A. | 用饱和食盐水和稀硫酸为原料制取HCl | |
| B. | 用大理石和稀硫酸制取CO2 | |
| C. | 用铁和盐酸为原料制取H2 | |
| D. | 用双氧水和二氧化锰为原料制取O2 |
19.下列说法不正确的是( )
| A. | 在粗盐提纯中,当加热到蒸发皿中有较多固体析出,残留少量液体时,停止加热,用余热将液体蒸干 | |
| B. | 当振荡分液漏斗中的混合溶液时,须用一只手压住分液漏斗的玻璃塞,另一只手握住旋塞,将分液漏斗倒转过来,用力振荡 | |
| C. | 粗盐提纯得到精盐的过程一定需要两次过滤操作 | |
| D. | 实验过程中若皮肤不慎沾上少量碱液,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗 |

 和
和