题目内容
14.下列说法正确的是( )| A. | 放热反应不需要加热就能发生 | |
| B. | 升高温度或加入催化剂,均可以改变化学反应的反应热 | |
| C. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 | |
| D. | 一定条件下某吸热反应能自发进行,说明该反应是熵增大的反应 |
分析 A、某些放热反应需要一定的引发条件才能发生反应;
B、催化剂改变反应速率,不能改变化学平衡;
C、根据△H=生成物的焓-反应物的焓可知,焓变与反应条件无关;
D、△H-T△S<0的反应能够自发进行.
解答 解;A、放热反应在常温下不一定很容易发生,如碳与氧气的反应为放热反应,但须点燃,故A错误;
B、升高温度,可以改变化学反应的反应热,加入催化剂改变反应速率,不能改变化学平衡,故B错误;
C、根据△H=生成物的焓-反应物的焓可知,焓变与反应条件无关,在光照和点燃条件下该反应的△H相同,故C错误;
D、吸热反应能够自发进行,必须是熵增大才能够使△H-T△S<0,故D正确;
故选D.
点评 本题考查化学反应中能量的变化,着重于对概念的理解,注意放热反应、吸热反应与反应物、生成物以及反应速率、反应条件之间有无必然关系,做题时不要混淆.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
4.合成氨工业对化学工业和国防工业具有重要意义,对农业生产起着重要作用.
(1)已知:N2(g)+O2(g)=2NO(g)△H1
H2(g)+$\frac{1}{2}$O2(g)=H2O(1)△H2
4NH3(g)+5O2(g)=4NO(g)+6H2O(1)△H3
N2(g)+3H2(g)?2NH3(g)△H4<0
则△H4=△H1+3△H2-$\frac{1}{2}$△H3(用含△H1、△H2、△H3的代数式表示).
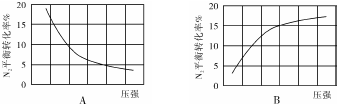
(2)在其他条件相同时,分别测定合成氨反应中N2的平衡转化率随压强变化的曲线如图A、B所示,其中正确的是B(填“A”或“B”),其判断理由是合成氨反应为气体分子数减小的反应,增大压强,平衡正移,反应物的转化率增大.
(3)在体积为2L的密闭容器中按物质的量1:3的比例充入N2、H2,进行下列四组合成氨实验:
①实验Ⅰ前10秒的平均速率v(NH3)=0.0011mol•L-1•s-1,T1温度下合成氨反应的平衡常数K=$\frac{0.022}{0.04×0.123}$ (mol•L-1)-2(列出计算式).
②与实验Ⅰ相比,实验Ⅱ改变了一个条件,该条件可能是加催化剂.
③与实验I相比,实验Ⅲ中N2的平衡转化率增大(填“增大”、“减小”或“不变”),平衡常数K不变(填“增大”、“减小”或“不变”).
④实验Ⅲ与实验Ⅳ的反应条件温度不同,则T1小于(填“大于”、“小于”或“等于”)T2,原因是T2时的平衡常数小于T1时的平衡常数且正反应放热.
(1)已知:N2(g)+O2(g)=2NO(g)△H1
H2(g)+$\frac{1}{2}$O2(g)=H2O(1)△H2
4NH3(g)+5O2(g)=4NO(g)+6H2O(1)△H3
N2(g)+3H2(g)?2NH3(g)△H4<0
则△H4=△H1+3△H2-$\frac{1}{2}$△H3(用含△H1、△H2、△H3的代数式表示).
(2)在其他条件相同时,分别测定合成氨反应中N2的平衡转化率随压强变化的曲线如图A、B所示,其中正确的是B(填“A”或“B”),其判断理由是合成氨反应为气体分子数减小的反应,增大压强,平衡正移,反应物的转化率增大.

(3)在体积为2L的密闭容器中按物质的量1:3的比例充入N2、H2,进行下列四组合成氨实验:
| 组别 | 温度 | N2起始量/mol | N2的物质的量/mol | ||||||
| 5(s) | 10(s) | 15(s) | 20(s) | 25(s) | 30(s) | 35(s) | |||
| Ⅰ | T1 | 0.1 | 0.094 | 0.089 | 0.085 | 0.0825 | 0.081 | 0.080 | 0.080 |
| Ⅱ | T2 | 0.1 | 0.090 | 0.085 | 0.082 | 0.080 | 0.080 | 0.080 | 0.080 |
| Ⅲ | T3 | 0.2 | 0.179 | 0.165 | 0.153 | 0.146 | x | x | x |
| Ⅳ | T4 | 0.2 | 0.173 | 0.161 | 0.155 | 0.150 | 0.150 | 0.150 | 0.150 |
②与实验Ⅰ相比,实验Ⅱ改变了一个条件,该条件可能是加催化剂.
③与实验I相比,实验Ⅲ中N2的平衡转化率增大(填“增大”、“减小”或“不变”),平衡常数K不变(填“增大”、“减小”或“不变”).
④实验Ⅲ与实验Ⅳ的反应条件温度不同,则T1小于(填“大于”、“小于”或“等于”)T2,原因是T2时的平衡常数小于T1时的平衡常数且正反应放热.
5.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4LH2O含有的分子数为NA | |
| B. | 常温常压下,32g O2含有的氧原子数为2NA | |
| C. | 通常状况下,NA个CO2分子占有的体积为22.4L | |
| D. | 1L 0.1mol/L NaCl溶液中所含的Na+为NA |
2.下列有关物理量相应的单位表达中,错误的是( )
| A. | 摩尔质量g/mol | B. | 气体摩尔体积L/mol | ||
| C. | 溶解度g/100g | D. | 物质的量浓度mol/L |
9.有以下四种物质:①标况下11.2LCO2 ②1g H2③1.204×1024个N2④4℃时18mlH2O,下列说法不正确的是( )
| A. | 分子个数:③>④>①=② | B. | 原子个数:③>④>①>② | ||
| C. | 质 量:③>①>④>② | D. | 体 积:③>④>①=② |
19.下列变化与氧化还原反应无关的是( )
| A. | 钢铁冶炼 | B. | 汽油燃烧 | C. | 酸碱中和 | D. | 食物腐败 |
6.如图为用球棍模型表示的某有机反应过程的示意图,该反应的类型是( )


| A. | 取代反应 | B. | 加成反应 | C. | 聚合反应 | D. | 氧化反应 |
4.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,11.2L苯中含有分子的数目为0.5NA | |
| B. | 常温常压下,5.6g乙烯(C2H4)与丁烯(C4H8)的混合物中含有的氢原子的数目为0.8NA | |
| C. | 在50 g质量分数为46%的乙醇水溶液中,含有的氢原子总数为3NA | |
| D. | 1mol Fe与足量的稀硫酸反应转化为Fe3+失去的电子数为3NA |