题目内容
2.将足量SO2通入下列溶液中,能产生浑浊的有( )①Ba(OH)2溶液②CaCl2溶液 ③H2S溶液 ④Ba(NO3)2溶液 ⑤Na2SiO3溶液.
| A. | ③④⑤ | B. | ②③⑤ | C. | ①③④⑤ | D. | ②③④⑤ |
分析 ①SO2能与Ba(OH)2溶液反应:SO2+Ba(OH)2=BaSO3↓+H2O,BaSO3+SO2+H2O=Ba(HSO3)2;
②盐酸酸性大于亚硫酸,二氧化硫与氯化钙不反应;
③二氧化硫与硫化氢反应生成单质硫,硫不溶液水,有沉淀;
④二氧化硫通入硝酸钡,二氧化硫被氧化生成硫酸根离子,硫酸根离子与钡离子反应生成硫酸钡沉淀;
⑤酸性亚硫酸大于硅酸,则反应生成硅酸沉淀.
解答 解:①SO2能与Ba(OH)2溶液反应:SO2+Ba(OH)2=BaSO3↓+H2O,BaSO3+SO2+H2O=Ba(HSO3)2,所以足量的二氧化硫无沉淀生成,故不选;
②盐酸酸性大于亚硫酸,二氧化硫与氯化钙不反应,无浑浊,故不选;
③二氧化硫与硫化氢反应生成单质硫,硫不溶液水,有沉淀,故选;
④二氧化硫通入硝酸钡,二氧化硫被氧化生成硫酸根离子,硫酸根离子与钡离子反应生成硫酸钡沉淀,故选;
⑤酸性亚硫酸大于硅酸,则反应生成硅酸沉淀,故选;
故选A.
点评 本题考查二氧化硫的化学性质,为高频考点,把握二氧化硫的还原性及发生的氧化还原反应为解答的关键,题目难度不大.

练习册系列答案
相关题目
10.由1-氯丙烷合成少量的2-丙醇,需要经过下列哪几步反应( )
| A. | 加成→消去→取代 | B. | 消去→加成→水解 | C. | 取代→消去→加成 | D. | 消去→加成→消去 |
13.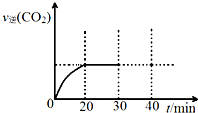 消除大气污染有多种方法.
消除大气污染有多种方法.
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+2NO2(g)═N2 (g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1
③H2O(g)═H2O(l)△H=-44.0kJ•mol-1
写出CH4(g)与NO(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(l)△H=-1248kJ•mol-1.
(2)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理.已知含SO2的废气通入含Fe2+、Fe3+的溶液时,首先是Fe3+被还原成Fe2+,接着Fe2+再被氧化成Fe3+.后一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O.
(3)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2(g)+CO2 (g).某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如表:
①10min~20min以v(CO2) 表示的平均反 应速率为0.009mol•L-1•min-1.
②根据表中数据,计算T1℃时该反应的平衡常数K=0.56(保留两位小数).
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率不变(填“增大”、“不变”或“减小”).
④请在图中画出30min至40min的变化曲线.
 消除大气污染有多种方法.
消除大气污染有多种方法.(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+2NO2(g)═N2 (g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1
③H2O(g)═H2O(l)△H=-44.0kJ•mol-1
写出CH4(g)与NO(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(l)△H=-1248kJ•mol-1.
(2)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理.已知含SO2的废气通入含Fe2+、Fe3+的溶液时,首先是Fe3+被还原成Fe2+,接着Fe2+再被氧化成Fe3+.后一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O.
(3)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2(g)+CO2 (g).某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如表:
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
②根据表中数据,计算T1℃时该反应的平衡常数K=0.56(保留两位小数).
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率不变(填“增大”、“不变”或“减小”).
④请在图中画出30min至40min的变化曲线.
10.下列表示物质结构的化学用语正确的是( )
| A. | 镁离子的电子式:Mg2+ | B. | HF的电子式:H:F | ||
| C. | Cl-离子的结构示意图: | D. | NH4Cl的电子式: |
7.下列物质中既有离子键又有非极性共价键的是( )
| A. | MgO | B. | Na2O2 | C. | CaCl2 | D. | NH4Cl |
14.下列对一些实验事实的理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | 足球烯(C60)在苯中的溶解度比在乙醇中的溶解度大 | C60易溶于非极性溶剂苯而难溶于乙醇,符合相似相溶原理 |
| B | Fe3+可用SCN-检验 | 生成了Fe(SCN)3红色沉淀 |
| C | Cu(OH)2可溶于氨水 | 可生成深蓝色溶液[Cu(H2O)4]SO4 |
| D | HF的沸点高于HCl | HF的键长比HCl短 |
| A. | A | B. | B | C. | C | D. | D |
11.在冶炼铁的反应3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$3CO2+2Fe中,作还原剂的是( )
| A. | CO | B. | Fe2O3 | C. | CO2 | D. | Fe |
12.下列实验方案中,不能达到实验目的是( )
| 项目 | 实验目的 | 实验方案 |
| A | 验证稀硫酸和稀硝酸的氧化性强弱 | 将两块相同的铜片分别加入浓度均为2mol/L的硫酸和硝酸中,观察反应的难易程度 |
| B | 验证Cu、Fe的还原性强弱 | 将铁丝和铜丝分别插入浓硝酸中,观察反应的剧烈程度 |
| C | 验证Br、I非金属性强弱 | 将少量溴水加入KI-淀粉溶液中,观察溶液是否变蓝色 |
| D | 验证Mg、Al的金属性强弱 | 在Mg(OH)2、Al(OH)3中分别加入稀氨水,观察沉淀能否溶解 |
| A. | A | B. | B | C. | C | D. | D |
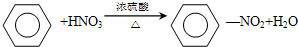 ,属于取代反应;
,属于取代反应; ,属于加成反应;
,属于加成反应; +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ +HBr,属于取代反应;
+HBr,属于取代反应;