题目内容
17.同学们已经学习了几种典型的有机化学反应类型--取代反应、加成反应、酯化反应.写出下列反应的化学反应方程式,并判断其反应类型.①乙醇与金属钠反应:2Na+2CH3CH2OH→2CH3CH2ONa+H2↑,属于置换反应;
②由苯制取硝基苯:
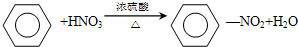 ,属于取代反应;
,属于取代反应;③由苯制取环己烷:
 ,属于加成反应;
,属于加成反应;④乙醇与乙酸反应:CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,属于取代反应;
⑤由苯制取溴苯:
 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ +HBr,属于取代反应;
+HBr,属于取代反应;⑥乙烯与氯化氢反应:CH2═CH2+HCl→CH3CH2Cl,属于加成反应.
分析 ①乙醇含-OH,与Na发生置换反应生成氢气;
②苯中H被硝基取代,生成硝基苯;
③苯与氢气发生加成反应;
④发生酯化反应生成乙酸乙酯,为取代反应;
⑤苯中H被溴取代生成溴苯;
⑥乙烯含碳碳双键,与HCl发生加成反应.
解答 解:①乙醇含-OH,与Na发生置换反应生成氢气,反应为2Na+2CH3CH2OH→2CH3CH2ONa+H2↑,为置换反应,
故答案为:2Na+2CH3CH2OH→2CH3CH2ONa+H2↑;置换;
②在浓硫酸作催化剂、加热条件下,苯中的氢原子被硝基取代生成硝基苯,所以该反应属于取代反应,反应方程式为 ,
,
故答案为: ;取代;
;取代;
③在镍作催化剂、加热条件下,苯和氢气发生加成反应生成环己烷,该反应属于加成反应,反应方程式为: ,
,
故答案为: ;加成;
;加成;
④乙酸和乙醇在浓硫酸作用下发生酯化反应,生成乙酸乙酯和水,反应方程式为CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,为取代反应,
故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O;取代;
⑤苯和溴单质在催化剂作用下可以生成溴苯,即 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ +HBr,为取代反应,
+HBr,为取代反应,
故答案为: +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ +HBr;取代;
+HBr;取代;
⑥乙烯可以和氯化氢之间发生加成反应生成氯乙烷,化学方程式为CH2═CH2+HCl→CH3CH2Cl,属于加成反应,
故答案为:CH2═CH2+HCl→CH3CH2Cl;加成.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意有机反应类型及反应条件,题目难度不大.

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案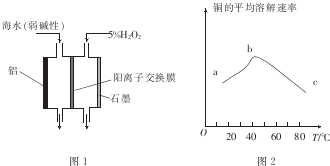
(1)常温下,用CO、O2和水在三苯基膦钯的催化下即可制得H2O2.相对于电解氢氧化钠溶液制H2O2,该方法具有的优点是安全、能耗低.
(2)图1是铝/过氧化氢电池结构示意图.铝电极为负极(填“正极”或“负极”),石墨电极的电极反应式为H2O2+2e-=2OH-
(3)印刷电路板中的金属铜可用10%的H2O2溶液和3.0mol.L-l的H2S04溶液处理,其他条件相同时,测得铜的平均溶解速率与温度的关系如图2所示.其中bc段曲线变化的主要原因是随着温度的升高,双氧水的分解速率加快
(4)为研究硫酸铁的量对过氧化氢分解速率的影响,某同学设计了如下一系列的实验.将表中所给的溶液分别加入A、B、C、D 4个反应瓶中,收集产生的气体,记录数据.
| 实验 体积/mL 液体 | A | B | C | D |
| 0.4mol.L-1Fe2(SO4)3溶液 | 0 | 1.8 | 2.0 | V1 |
| 30%H2O2溶液 | 20.0 | 20.0 | 20.0 | 20.0 |
| HO2 | V2 | V3 | 15.0 | 13.8 |
②上表中V3=15.2.
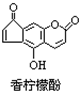
| A. | 它的分子式为C13H9O4 | |
| B. | 它与H2发生加成反应,1mol最多可消耗7mol H2 | |
| C. | 它与溴水发生反应,1mol最多消耗3mol Br2 | |
| D. | 它与NaOH溶液反应,1mol最多消耗2molNaOH |
①苯 ②苯乙烯 ③甲苯 ④乙醇 ⑤己烯 ⑥己烷 ⑦亚硫酸
⑧聚丁二烯 ⑨聚乙烯 ⑩聚乙炔.
| A. | ②⑤⑧⑨⑩ | B. | ②④⑥⑦ | C. | ②⑤⑦⑧⑩ | D. | ①②③④⑤⑥⑦⑧ |
①Ba(OH)2溶液②CaCl2溶液 ③H2S溶液 ④Ba(NO3)2溶液 ⑤Na2SiO3溶液.
| A. | ③④⑤ | B. | ②③⑤ | C. | ①③④⑤ | D. | ②③④⑤ |
| A. | 酸性:H2SO4>H3PO4 | B. | 非金属性:Cl>S | ||
| C. | 热稳定性Na2CO3>NaHCO3 | D. | 碱性:NaOH>Mg(OH)2 |
| A. | 0.1 mol/(L•min) | B. | 3.6 mol/(L•min) | C. | 1.2 mol/(L•min) | D. | 0.017mol/(L•min) |
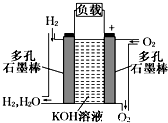 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: