题目内容
10.由1-氯丙烷合成少量的2-丙醇,需要经过下列哪几步反应( )| A. | 加成→消去→取代 | B. | 消去→加成→水解 | C. | 取代→消去→加成 | D. | 消去→加成→消去 |
分析 由1-氯丙烷合成少量的2-丙醇,需要进行如下转化:CH2ClCH2CH3→CH2=CHCH3→CH3CHClCH3→CH3CHOHCH3,以此来解答.
解答 解:由1-氯丙烷合成少量的2-丙醇,发生
CH2ClCH2CH3+NaOH$→_{△}^{醇}$CH2=CHCH3+NaCl+H2O,为消去反应;
CH2=CHCH3+HCl$\stackrel{过氧化物}{→}$CH3CHClCH3,为加成反应;
CH3CHClCH3+NaOH$→_{△}^{H_{2}O}$CH3CHOHCH3+NaCl,为水解反应,
则需要经过消去→加成→水解合成2-丙醇,
故选B.
点评 本题考查有机物的合成,为高频考点,把握合成反应中官能团的变化、发生的反应为解答的关键,侧重分析与应用能力的考查,注意卤代烃的消去、水解反应条件,题目难度不大.

练习册系列答案
相关题目
20.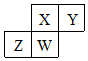 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )
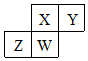 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 元素X、Y、Z、W的最高化合价分别与其主族序数相等 | |
| C. | 最简单气态氢化物的热稳定性:H2Y>XH3>WH3>ZH4 | |
| D. | 最高价氧化物对应水化物的酸性:HXO3>H3WO4>H2ZO3 |
1.某原电池的总反应的离子方程式为:Zn+Cu2+═Zn2++Cu,则该原电池的正确组成可以是下列的( )
| A. | 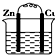 CuSO4溶液 | B. | 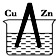 ZnSO4溶液 | ||
| C. | 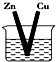 酒精 | D. | 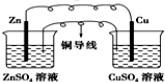 |
18. X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法正确的是( )
 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法正确的是( )| A. | 五种元素中,原子半径最大的是W | |
| B. | Y与Z形成的化合物都可以和盐酸反应 | |
| C. | 简单阴离子的还原性:Y>W | |
| D. | Z与Q形成的化合物水溶液一定显酸性 |
2.某芳香烃的分子式为C9H10且分子中除苯环外不含其他环状结构,该芳香烃共有(不考虑立体异构)( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
1.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu,Zn+H2SO4=ZnSO4+H2↑;
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4 与Zn反应产生的 Cu 与Zn形成铜锌原电池,加快了氢气产生的速率;
(3)实验室中现有Na2SO4、MgSO4、AgNO3、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是AgNO3;
(4)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度;适当增加硫酸的浓度、增加锌粒的表面积等 (任答一种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10.
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu,Zn+H2SO4=ZnSO4+H2↑;
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4 与Zn反应产生的 Cu 与Zn形成铜锌原电池,加快了氢气产生的速率;
(3)实验室中现有Na2SO4、MgSO4、AgNO3、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是AgNO3;
(4)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度;适当增加硫酸的浓度、增加锌粒的表面积等 (任答一种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | 30 | 30 | 30 | 30 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | 20 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
2.将足量SO2通入下列溶液中,能产生浑浊的有( )
①Ba(OH)2溶液②CaCl2溶液 ③H2S溶液 ④Ba(NO3)2溶液 ⑤Na2SiO3溶液.
①Ba(OH)2溶液②CaCl2溶液 ③H2S溶液 ④Ba(NO3)2溶液 ⑤Na2SiO3溶液.
| A. | ③④⑤ | B. | ②③⑤ | C. | ①③④⑤ | D. | ②③④⑤ |
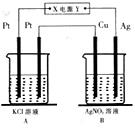 如图所示,常温下电解5min后,铜电极质量增加1,08g,试回答:
如图所示,常温下电解5min后,铜电极质量增加1,08g,试回答: