题目内容
8.二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物.制备ClO2的方法有多种,其中一种方法的化学方程式如下:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
(1)该反应的还原剂是H2O2,若反应中有0.1mol电子转移,则产生的ClO2气体在标准状况下的体积为2.24L;
(2)用双线桥法在下面的反应式上标出电子转移的方向与数目.2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
(3)某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为4:1.
分析 (1)2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+2Na2SO4+2H2O中,Cl元素的化合价降低,O元素的化合价升高,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,据此分析解答;
(2)Cl元素的化合价降低1价,O元素的化合价升高1价,转移2个电子;
(3)可以根据反应物和生成物来书写方程式,从反应中找到被还原的氯元素即化合价降低的氯元素,被氧化的氯元素即化合价升高的氯元素,或者根据电子守恒来确定.
解答 解:(1)2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+2Na2SO4+2H2O中,O元素的化合价升高,则H2O2为还原剂被氧化,Cl元素的化合价由+5价降低为+4价,转移1个电子,反应中有0.1mol电子转移,则产生的ClO2气体在标准状况下的体积为0.1mol×22.4L/mol=2.24L,该反应中O元素的化合价升高,则H2O2为还原剂被氧化;
故答案为:H2O2;2.24;
(2)Cl元素的化合价由+5价降低为+4价,转移2个电子,其转移电子的方向和数目为 ;
;
故答案为: .
.
(3)根据ClO-与ClO3-的浓度之比1:3,由Cl到ClO-,失去1个电子,由Cl到ClO3-,失去5个电子,一共失去1+3×5=16个电子;由Cl到Cl-,得到1个电子,需要16个原子才能得到16个电子,所以,被还原的氯元素与被氧化的氯元素的物质的量之比=16:(1+3)=4:1,
故答案为:4:1.
点评 本题考查了氧化还原反应计算、概念以及化合价升降和电子转移知识,难度中等,注意知识的归纳和梳理是关键,明确元素化合价的变化是解题的关键,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
17.下列说法正确的是( )
| A. | 反应C(s)+H2O(g)═CO(g)+H2(g)的△H>0,△S>0 | |
| B. | 铅酸蓄电池放电时,负极质量减少,正极质量增加 | |
| C. | 向Na2S溶液中加入少量NaOH固体后,溶液中c(Na+)/c(S2- )减少 | |
| D. | 向平衡体系CH3COOH+C2H5OH?CH3COOC2H5+H2O中,加少量浓硫酸,乙酸转化率不变 |
19.下列说法中一定正确的是( )
| A. | Na2O2固体中阳离子与阴离子的个数比为1:1 | |
| B. | 从试剂瓶中取出并切下的未使用的钠可放回原试剂瓶中 | |
| C. | 将Na投入饱和Na2CO3溶液中,会导致溶液质量增加 | |
| D. | 金属Na失火,可用CO2灭火 |
3.沼气是一种能源,它的主要成分是 CH4,0.5mol CH4完全燃烧生成 CO2和 液态水时,放出 445kJ热量,则下列热化学方程式中正确的是( )
| A. | 2CH4(g)+4O2(g)→2CO2(g)+4H2O(1);△H=+890kJ•mol-1 | |
| B. | CH4(g)+2O2(g)→CO2(g)+2H2O(1);△H=+445kJ•mol-1 | |
| C. | CH4(g)+2O2(g)→CO2(g)+2H2O(1);△H=+890kJ•mol-1 | |
| D. | $\frac{1}{2}$CH4(g)+O2(g)=$\frac{1}{2}$CO2(g)+H2O(1);△H=-445kJ•mol-1 |
17. (1)已知反应 2HI(g)?H2(g)+I2(g)的△H=+11kJ/mol,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为299kJ.
(1)已知反应 2HI(g)?H2(g)+I2(g)的△H=+11kJ/mol,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为299kJ.
(2)Bodensteins 研究了下列反应:2HI(g)?H2(g)+I2(g)在 716K 时,气体混合物中碘化氢的物质的量分数 x(HI)与反应时间 t 的关系如表:
①根据上述实验结果,该反应的平衡常数K的计算式为$\frac{0.10{8}^{2}}{0.78{4}^{2}}$.
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为$\frac{{K}_{正}}{K}$(以K和k正表示).若 k正=0.0027min-1,在 t=40min 时,v正=1.95×10-3 min-1.
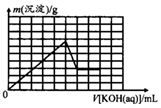
③由上述实验数据计算得到v正~x(HI)和 v逆~x(H2)的关系如图所示.当升高到某一温度时,反应重新达到平衡,相应的点依次为A(填字母)和E(填字母).
 (1)已知反应 2HI(g)?H2(g)+I2(g)的△H=+11kJ/mol,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为299kJ.
(1)已知反应 2HI(g)?H2(g)+I2(g)的△H=+11kJ/mol,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为299kJ.(2)Bodensteins 研究了下列反应:2HI(g)?H2(g)+I2(g)在 716K 时,气体混合物中碘化氢的物质的量分数 x(HI)与反应时间 t 的关系如表:
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为$\frac{{K}_{正}}{K}$(以K和k正表示).若 k正=0.0027min-1,在 t=40min 时,v正=1.95×10-3 min-1.
③由上述实验数据计算得到v正~x(HI)和 v逆~x(H2)的关系如图所示.当升高到某一温度时,反应重新达到平衡,相应的点依次为A(填字母)和E(填字母).
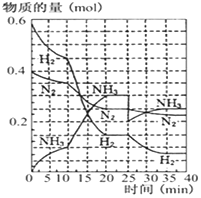 德国人发明了合成氨反应,其原理为:N2(g)+3H2(g)?2NH3(g);已知298K时,△H=-92.4kJ•mol-1,在500℃,20Mpa时,将氮气和氢气通入到体积为2升的密闭容器中,反应过程中各种物质的量变化如右图所示.
德国人发明了合成氨反应,其原理为:N2(g)+3H2(g)?2NH3(g);已知298K时,△H=-92.4kJ•mol-1,在500℃,20Mpa时,将氮气和氢气通入到体积为2升的密闭容器中,反应过程中各种物质的量变化如右图所示.