题目内容
3.已知A(g)+B(g)?C(g)+D(g)反应的平衡常数和温度的关系如下:| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应平衡常数表达式为K=$\frac{c(C)•c(D)}{c(A)•c(B)}$;△H<0(选填“>”、“<”或“=”).
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,若测得反应初始至6S内A的平均反应速率v(A)=0.002mol•L-1•S-1,则6S时c(A)=0.028 mol•L-1;C的物质的量为0.06mol.
(3)在与(2)相同的温度、容器及A、B配比下反应经一段时间后达到平衡,此时A的转化率为80%;保持温度、容器不变,再向密闭容器中充入0.20mol的A和0.80mol的B,此时A的转化率为80%;如果这时向该密闭容器中再充入1mol氩气,则平衡时A的转化率不变(选填“增大”、“减小”、“不变”).
(4)判断该反应是否达到平衡的依据为ce(填正确选项的字母).
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
e.单位时间内生成amolA的同时,消耗amolB
(5)1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为2.5.
分析 (1)平衡常数是平衡时生成物浓度幂之积比上反应物浓度幂之积;温度越高平衡常数越小,所以正反应是放热反应;
(2)根据△c=v△t计算△c(A),A的起始浓度-△c(A)=6s时c(A);
根据△n=△cV计算△n(A),再根据方程式计算C的物质的量;
(3)设平衡时A的浓度变化量为x,利用三段式表示平衡时各组分的平衡浓度,代入平衡常数列方程计算x的值,再根据转化率定义计算;保持温度、容器不变,再向密闭容器中充入0.20mol的A和0.80mol的B,相当于给原平衡体系加压,所以此时A的转化率不变;体积不变,充入1mol氩气,反应混合物各组分的浓度不变,变化不移动,A的转化率不变;
(4)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(5)同一反应在相同温度下,正、逆反应方向的平衡常数互为倒数.
解答 解:(1)已知A(g)+B(g)?C(g)+D(g)反应,平衡常数K=$\frac{c(C)•c(D)}{c(A)•c(B)}$;由表可知温度越高平衡常数越小,所以△H<0,故答案为:K=$\frac{c(C)•c(D)}{c(A)•c(B)}$;<;
(2)反应初始6s内A的平均反应速率v(A)=0.002mol•L-1•s-1,则6s内△c(A)=0.002mol•L-1•s-1×6s=0.012mol/L,A的起始浓度为$\frac{0.2mol}{5L}$=0.04mol/L,故6s时时c(A)=0.04mol/L-0.012mol/L=0.028mol/L,
故6s内△n(A)=0.012mol/L×5L=0.06mol,由方程式可知n(C)=△n(A)=0.06mol,故答案为:0.028;0.06;
(3)设平衡时A的浓度变化量为x,则:
A(g)+B(g)?C(g)+D(g)
开始(mol/L):0.04 0.16 0 0
变化(mol/L):x x x x
平衡(mol/L):0.04-x 0.16-x x x
故$\frac{{x}^{2}}{(0.04-x)(0.16-x)}$=1,解得x=0.032
所以平衡时A的转化率为$\frac{0.032mol/L}{0.04mol/L}$×100%=80%,
保持温度、容器不变,再向密闭容器中充入0.20mol的A和0.80mol的B,相当于给原平衡体系加压,所以此时A的转化率不变,仍为80%,
体积不变,充入1mol氩气,反应混合物各组分的浓度不变,变化不移动,A的转化率不变为80%,
故答案为:80%;80%;不变;
(4)a.该反应前后气体的物质的量不变,压强始终不变,故压强不随时间改变,不能说明到达平衡,故a错误,
b.混合气体的总质量不变,容器的容积不变,故混合气体的密度始终不变,故气体的密度不随时间改变,不能说明到达平衡,故b错误,
c.可逆反应到达平衡时,各组分的浓度不发生变化,故c(A)不随时间改变,说明到达平衡,故c正确,
d.单位时间里生成C和D的物质的量相等,都表示正反应速率,反应始终按1:1生成C、D的物质的量,不能说明到达平衡,故d错误,
e.单位时间内生成amolA等效于生成amolB的同时消耗amolB,达平衡状态,故e正确;
故答案为:ce;
(5)同一反应在相同温度下,正、逆反应方向的平衡常数互为倒数,故1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为$\frac{1}{0.4}$=2.5,
故答案为:2.5.
点评 本题考查化学平衡计算、平衡常数计算、化学反应速率、平衡状态判断,难度中等,注意化学平衡状态判断,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案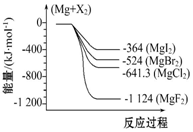 如图是金属镁和卤素反应的能量变化图(反应物和生成物均为298K时的稳定状态).下列选项中不正确的是( )
如图是金属镁和卤素反应的能量变化图(反应物和生成物均为298K时的稳定状态).下列选项中不正确的是( )| A. | Mg与F2反应放热最多 | |
| B. | MgF2(s)+Br2(l)═MgBr2(s)+F2(g)吸热 | |
| C. | MgBr2与Cl2反应放热 | |
| D. | 化合物的热稳定顺序:MgI2>MgBr2>MgCl2>MgF2 |
| A. | 苯中含有少量甲苯 | B. | 乙醇中含有少量乙酸 | ||
| C. | 溴苯中含有少量苯 | D. | 乙酸乙酯中含有少量乙酸 |
| A. | 反应C(s)+H2O(g)═CO(g)+H2(g)的△H>0,△S>0 | |
| B. | 铅酸蓄电池放电时,负极质量减少,正极质量增加 | |
| C. | 向Na2S溶液中加入少量NaOH固体后,溶液中c(Na+)/c(S2- )减少 | |
| D. | 向平衡体系CH3COOH+C2H5OH?CH3COOC2H5+H2O中,加少量浓硫酸,乙酸转化率不变 |
 铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)═Fe(s)+CO2(g)△H1
Fe2O3(s)+$\frac{1}{3}$CO(g)═$\frac{2}{3}$Fe3O4(s)+$\frac{1}{3}$CO2(g)△H2
Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H3
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H4
则△H4的表达式为△H2+$\frac{2}{3}$△H3(用含△H1、△H2、△H3的代数式表示).
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下:
| 温度 | 250℃ | 600℃ | 1000℃ | 2000℃ |
| 主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
m(Fe):m(O)=35:2,则FeO被CO还原为Fe的百分率为80%(设其它固体杂质中不含Fe、O元素).
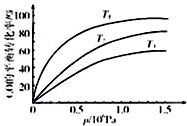
(3)铁等金属可用作CO与氢气反应的催化剂.已知某种催化剂可用来催化反应CO(g)+3H2(g)?CH4(g)+H2O(g)△H<0.在T℃,106Pa时将l mol CO和3mol H2加入体积可变的密闭容器中.实验测得CO的体积分数x(CO)如表:
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| x(CO) | 0.25 | 0.23 | 0.214 | 0.202 | 0.193 | 0.193 |
a.容器内压强不再发生变化
b.混合气体的密度不再发生变化
c.v正(CO)=3v逆(H2)
d.混合气体的平均相对分子质量不再发生变化
②达到平衡时CO的转化率为37.1%;
③图表示该反应CO的平衡转化率与温度、压强的关系.图中温度T1、T2、T3由高到低的顺序是T3>T2>T1,理由是正反应放热,在相同压强下,温度降低,平衡向正反应方向移动,CO的转化率越高..
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致.则溶液呈黄色是含Br2(填化学式或离子符号,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+所致.
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.供选用的试剂:
A.酚酞试液 B.四氯化碳 C.无水酒精 D.硫氰化钾溶液
请写出丙同学的一种方案,选用的试剂及实验现象填在下表空格中.(试剂填序号)
| 选用试剂 | 实验现象 | |
| 方案 | ①d或b | ②溶液变成血红色或下层的四氯化碳溶液依然无色 |
①在少量FeBr2溶液中通入足量Cl2,反应的离子方程式为2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有$\frac{1}{3}$的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1.2mol/L.
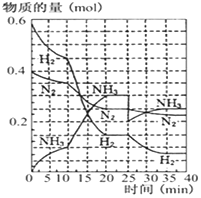 德国人发明了合成氨反应,其原理为:N2(g)+3H2(g)?2NH3(g);已知298K时,△H=-92.4kJ•mol-1,在500℃,20Mpa时,将氮气和氢气通入到体积为2升的密闭容器中,反应过程中各种物质的量变化如右图所示.
德国人发明了合成氨反应,其原理为:N2(g)+3H2(g)?2NH3(g);已知298K时,△H=-92.4kJ•mol-1,在500℃,20Mpa时,将氮气和氢气通入到体积为2升的密闭容器中,反应过程中各种物质的量变化如右图所示.