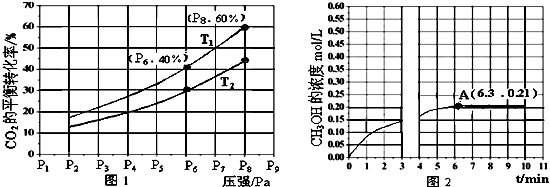
题目内容
10.A、B、D、E、F为短周期元素.非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍.B在D中充分燃烧能生成其最高价化合物BD2.E+与D2-具有相同的电子数.A在F中燃烧,产物溶于水得到一种强酸.回答下列问题:(1)写出工业制备单质F的离子方程式2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)B、D、E组成的一种盐中,E的质量分数为43%,其水溶液与F单质反应的化学方程式为2Na2CO3+Cl2+H2O═NaCl+NaClO+2NaHCO3.
(3)由这些元素组成的物质,其组成和结构信息如下表:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
| c | 化学组成为BDF2 |
| d | 只存在一种类型作用力且可导电的单质晶体 |
 ;d的晶体类型是金属.
;d的晶体类型是金属.
分析 A,B,D,E,F为短周期元素,非金属元素A最外层电子数与其周期数相同,则A为H;B的最外层电子数是其所在周期数的2倍,则B为C或S,B在D中充分燃烧能生成其最高价化合物BD2,则D为O,B的最高正价为+4价,则B为C;E+与D2-具有相同的电子数,则E为Na;A在F中燃烧,产物溶于水得到种强酸,则F为Cl;
(1)工业上常用电解饱和食盐水的方法来制备氯气;
(2)C、O、Na组成的化合物为碳酸钠,碳酸钠与氯气反应生成氯化钠、次氯酸钠、碳酸氢钠;
(3)这几种元素只有Na能与H形成离子化合物;根据常见的氧的化合物和碳的化合物分析;根据COCl2结构式分析;只存在一种类型作用力且可导电的单质晶体为Na.
解答 解:A,B,D,E,F为短周期元素,非金属元素A最外层电子数与其周期数相同,则A为H;B的最外层电子数是其所在周期数的2倍,则B为C或S,B在D中充分燃烧能生成其最高价化合物BD2,则D为O,B的最高正价为+4价,则B为C;E+与D2-具有相同的电子数,则E为Na;A在F中燃烧,产物溶于水得到种强酸,则F为Cl;
(1)工业上常用电解饱和食盐水的方法来制备氯气,其电解的离子方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑;
(2)C、O、Na组成的一种盐中,Na的质量分数为43%,则为碳酸钠,碳酸钠与氯气反应生成氯化钠、次氯酸钠、碳酸氢钠,反应的化学方程式为:2Na2CO3+Cl2+H2O═NaCl+NaClO+2NaHCO3,
故答案为:2Na2CO3+Cl2+H2O═NaCl+NaClO+2NaHCO3;
(3)这几种元素只有Na能与H形成离子化合物,则a的化学式为NaH;含有非极性共价键的二元离子化合物,且原子数之比为1:1,则b为Na2O2;已知COCl2结构式为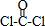 ,则其电子式为
,则其电子式为 ;只存在一种类型作用力且可导电的单质晶体为Na,Na属于金属晶体,
;只存在一种类型作用力且可导电的单质晶体为Na,Na属于金属晶体,
故答案为:NaH;Na2O2; ;金属.
;金属.
点评 本题考查位置结构性质的相互关系及运用,为高频考点,综合性较强,涉及元素推断、物质推断、化学用语等知识点,正确推断元素及物质、明确物质结构特点及基本原理是解本题关键,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 向碘化亚铁溶液中滴加溴的四氯化碳溶液2Br2+2Fe2++2I-═I2+4Br-+2Fe3+ | |
| B. | 向含等物质的量浓度AgNO3和Cu(NO3)2的溶液中缓慢加入镁粉4Cu2++2Ag++5Mg═4Cu+2Ag+5Mg2+ | |
| C. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O | |
| D. | 向明矾溶液中加入Ba(OH)2溶液至生成的沉淀物质的量最多:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
| A. | 乙炔 | B. | 乙烯 | C. | 丁二烯 | D. | 丙炔 |
| A. | 反应C(s)+H2O(g)═CO(g)+H2(g)的△H>0,△S>0 | |
| B. | 铅酸蓄电池放电时,负极质量减少,正极质量增加 | |
| C. | 向Na2S溶液中加入少量NaOH固体后,溶液中c(Na+)/c(S2- )减少 | |
| D. | 向平衡体系CH3COOH+C2H5OH?CH3COOC2H5+H2O中,加少量浓硫酸,乙酸转化率不变 |
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致.则溶液呈黄色是含Br2(填化学式或离子符号,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+所致.
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.供选用的试剂:
A.酚酞试液 B.四氯化碳 C.无水酒精 D.硫氰化钾溶液
请写出丙同学的一种方案,选用的试剂及实验现象填在下表空格中.(试剂填序号)
| 选用试剂 | 实验现象 | |
| 方案 | ①d或b | ②溶液变成血红色或下层的四氯化碳溶液依然无色 |
①在少量FeBr2溶液中通入足量Cl2,反应的离子方程式为2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有$\frac{1}{3}$的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1.2mol/L.
| A. | Na2O2固体中阳离子与阴离子的个数比为1:1 | |
| B. | 从试剂瓶中取出并切下的未使用的钠可放回原试剂瓶中 | |
| C. | 将Na投入饱和Na2CO3溶液中,会导致溶液质量增加 | |
| D. | 金属Na失火,可用CO2灭火 |